与肿瘤转移相关的代谢变化,第1部分:肿瘤pH值、糖酵解和戊糖磷酸途径
Metabolic changes associated with tumor metastasis, part 1: tumor pH, glycolysis and the pentose phosphate pathway
Cell Mol. Life Sci.2015;doi: 10.1007 / s00018 - 015 - 2098 - 5。
Payen VL, Porporato PE, Baselet B, Sonveaux P
出版日期:
2015年12月4日,星期五
代谢适应与细胞行为的变化密切相关。癌症的特征是由于突变和代谢表型的选择而导致的高代谢可塑性,从而具有生长和侵袭性优势。虽然代谢可塑性使癌细胞能够应对原发性肿瘤中可能遇到的各种微环境情况,但越来越多的证据表明,代谢也是癌症转移的一个主要驱动因素。与其将促进转移的一般开关作为一个整体,更有可能需要一系列的代谢适应来促进转移过程的不同步骤。本文综述了pH、糖酵解和戊糖磷酸途径的作用,并对线粒体、脂质和氨基酸代谢的作用进行了综述。细胞外酸化、细胞内碱化、糖酵解酶磷酸葡萄糖异构酶作为自分泌细胞因子、乳酸和戊糖磷酸途径是控制肿瘤转移的重要因素。
Metabolic changes associated with tumor metastasis, part 1: tumor pH, glycolysis and the pentose phosphate pathway
Cell Mol. Life Sci. 2015; doi: 10.1007/s00018-015-2098-5.
Payen VL, Porporato PE, Baselet B, Sonveaux P
Date of publication:
Friday, 4 December 2015
Metabolic adaptations are intimately associated with changes in cell behavior. Cancers are characterized by a high metabolic plasticity resulting from mutations and the selection of metabolic phenotypes conferring growth and invasive advantages. While metabolic plasticity allows cancer cells to cope with various microenvironmental situations that can be encountered in a primary tumor, there is increasing evidence that metabolism is also a major driver of cancer metastasis. Rather than a general switch promoting metastasis as a whole, a succession of metabolic adaptations is more likely needed to promote different steps of the metastatic process. This review addresses the contribution of pH, glycolysis and the pentose phosphate pathway, and a companion paper summarizes current knowledge regarding the contribution of mitochondria, lipids and amino acid metabolism. Extracellular acidification, intracellular alkalinization, the glycolytic enzyme phosphoglucose isomerase acting as an autocrine cytokine, lactate and the pentose phosphate pathway are
europepmc.org/abstract/MED/26626411
http://europepmc.org/abstract/MED/26626411
肿瘤微环境产生的酸性驱动局部入侵
Acidity generated by the tumor microenvironment drives local invasion
摘要
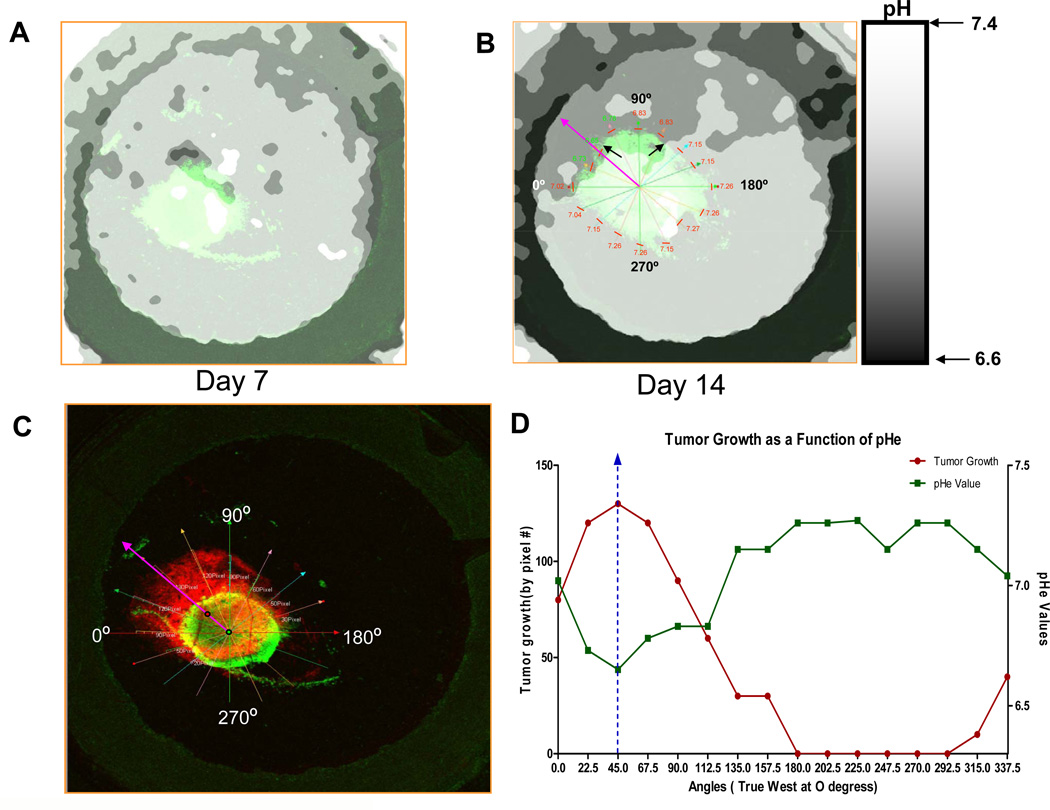
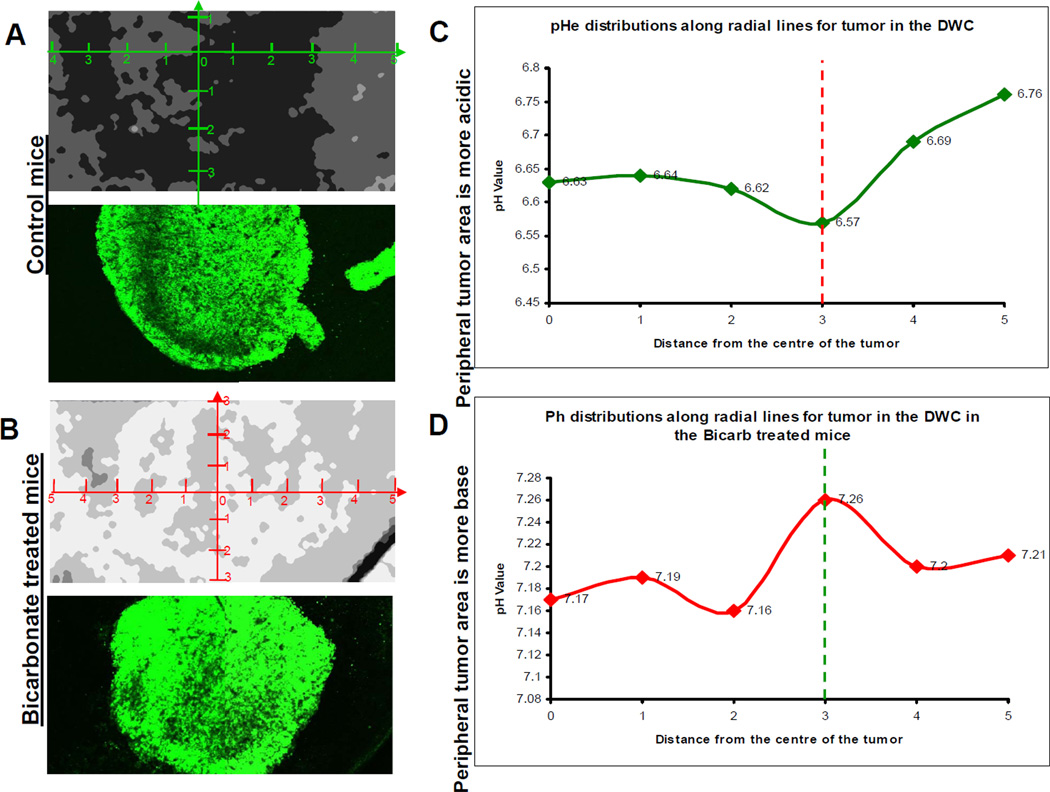
实体瘤的pH值由于发酵代谢的增加和灌注不良而呈酸性。已经假设酸性pH促进局部侵袭性生长和转移。酸介导入侵的假设表明,H +从近端肿瘤微环境扩散到相邻的正常组织中,在此附近,H +引起组织重塑,从而允许局部入侵。在目前的研究中,使用活体显微镜对肿瘤的侵袭和肿瘤周围的pH值进行了监测。在每种情况下,肿瘤周围的pH均为酸性和不均一的,并且肿瘤浸润最高的区域对应于pH最低的区域。 pHe正常或接近正常的区域未发生肿瘤浸润。
免疫组织化学分析显示,侵入性边缘的细胞表达了葡萄糖转运蛋白GLUT-1和钠氢交换蛋白NHE-1,两者均与肿瘤周围酸中毒有关。
为了支持我们研究结果的功能重要性,在临床前模型中口服碳酸氢钠足以增加肿瘤周围的pH值并抑制肿瘤生长和局部浸润,从而支持了酸介导的浸润假说。
介绍
绍 癌症侵袭邻近正常组织的倾向显着地促进了局部肿瘤的生长和转移的形成,这在很大程度上与肿瘤相关的发病率和死亡率有关(1)。肿瘤细胞入侵的机制很复杂,可以根据环境条件进行修改(2)。由于葡萄糖代谢增加,癌症中的H +产生和排泄通常会增加(3)。与生理条件下的正常组织(pHe = 7.2 – 7.4)相比,这与不良的灌注结合导致恶性肿瘤的酸性细胞外pH(pHe)(pH = 6.5 – 6.9)(4–6)。酸性pHe可以诱导体外释放(半胱氨酸或天冬氨酰)组织蛋白酶活性(7-9),通常认为这与局部浸润和组织重塑有关(10-12)。此外,暴露于体外低pH值的细胞在体外和体内均表现出增加的侵袭性(9、13、14)。这些观察结果是在“酸介导的入侵”假说中合成的,其中H +离子沿着浓度梯度从肿瘤流向相邻的正常组织,从而促进了肿瘤-基质界面的组织重塑(15)。由此产生的酸性环境对正常细胞有毒,通过蛋白酶促进细胞外基质的降解(16),通过释放VEGF增加血管生成,并抑制对肿瘤抗原的免疫反应(17-19)。癌细胞由于其增强的进化能力而发展出适应性机制,使它们能够在酸性环境中生存甚至增殖(20)。这些适应措施尤其可能涉及钠氢交换(NHE-1)或碳酸酐酶(CA-IX)的上调(21-23)。随着正常细胞的死亡和细胞外基质的降解,癌细胞继续增殖并侵入该开放空间。因此,我们提出,肿瘤微环境的酸性pH值代表了一种“利基工程”策略,该策略可促进恶性肿瘤的局部浸润和随后的体内生长。该模型的支持来自最近的观察结果,即用系统性缓冲液(例如碳酸氢盐,咪唑,赖氨酸)中和肿瘤衍生的酸可抑制自发转移和实验转移(8、24、25)。在这里,我们通过将肿瘤周围酸度的区域变化与随后的肿瘤浸润模式相关联,明确检查了酸介导的浸润模型。
研究酸介导的侵袭的重要工具是背窗室,该室最早于1987年开发出来(26)。我们以前曾使用该系统测试酸介导的入侵假说的各个方面,并定量测量了肿瘤来源的酸向周围基质的输出(16)。此外,在口服NaHCO3处理后,使用背窗室观察到肿瘤基质pH梯度的可测量降低,这已显示可减少自发或实验性转移的形成(8)。在当前的工作中,我们观察到肿瘤周围组织的酸性pHe与随后的肿瘤浸润的位置一致,这是对“酸介导的浸润”假说的特定预测。此外,碳酸氢盐处理降低了pH梯度并完全防止了入侵。因此,当前的发现直接支持“酸介导的入侵”假说。
讨论区
与癌症有关的发病率和死亡率在很大程度上与肿瘤的侵袭和转移的形成有关。 FDG-PET成像在临床癌症中的广泛应用已清楚地表明,绝大多数恶性肿瘤均以高速率代谢葡萄糖。 (33,34)。我们建议在葡萄糖代谢增加与癌细胞侵袭和转移能力之间存在直接的因果关系。
葡萄糖代谢升高是肿瘤微环境中酸性增加的直接原因。此外,大多数肿瘤会形成异常的脉管系统网络,该网络往往组织不良且渗漏,破坏了血液流动并阻碍了氧气的输送。 (35)。这对肿瘤酸度有两倍的影响。首先,它使肿瘤区域的灌注不良,因此氧合不良(36)。低氧合通过巴斯德效应增加糖酵解通量(37)。值得注意的是,即使在具有充足氧气供应的肿瘤区域,糖酵解和产酸也会通过Warburg效应上调(38)。其次,不良的灌注阻碍了微环境通过扩散去除肿瘤来源的酸的能力。因此,肿瘤的细胞外pH通常是高度酸性的,这将不可避免地导致酸扩散到周围的基质中。我们以前曾提出,侵袭性表型和葡萄糖代谢增加实际上是密切相关的(23)。这项工作大部分源于将癌症生物学视为生态和进化过程。在这种情况下,癌症中所有通常观察到的表型必须具有进化优势。在这种情况下,我们问“增加的葡萄糖代谢和随后的间质性酸中毒如何赋予促进肿瘤细胞增殖的进化优势”?这导致了这样的提议,即区域性酸中毒代表了一种自然界中普遍观察到的“利基工程”策略,在这种策略中,植物和动物以促进自身生长和生存和/或减少其竞争者的方式改变其环境。即使存在充足的氧气,肿瘤仍会利用糖代谢来提高自身的生态位,这一概念模型是“酸介导的入侵”假说的基础(15、16)。该模型假设通过致癌过程中的进化事件,随着癌细胞在上皮表面增殖(39),它们必须通过质子输出系统(如NHE-1或CA-IX)的表达来适应增加的酸产生,该系统从体内转运H +。 -至细胞外空间,导致细胞外酸化。然而,缺乏癌细胞进化能力的正常哺乳动物组织通常不耐受长时间暴露于酸性pH。该模型假定H +沿浓度梯度从肿瘤流向肿瘤周围正常组织,引起破坏,从而有利于随后的肿瘤生长。各种研究表明,酸性肿瘤周围pH可能与细胞外基质的降解有关,可能是通过蛋白水解酶的释放和激活引起的(7、16)。低pH值还导致正常细胞发生凋亡和坏死,而癌细胞由于获得性耐药机制而存活(40、41)。总之,区域性酸中毒通过正常的细胞死亡,细胞外基质的破坏,新血管形成的促进以及免疫应答的抑制而引起大量的利基工程(10、17、18)。
这项研究的结果表明,肿瘤细胞确实通过创建对恶性细胞无毒的酸性环境而确实执行了利基工程,但由于其对正常细胞和组织的不利影响,促进了局部侵袭。通过全身性缓冲液和其他降低肿瘤周期pH值的机制靶向这种进化策略,可能会为完全专注于杀死肿瘤细胞的传统疗法提供有价值的辅助手段或替代方法。Acidity generated by the tumor microenvironment drives local invasion
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3594450/Veronica Estrella,1,* Tingan Chen,3,* Mark Lloyd,3 Jonathan Wojtkowiak,1 Heather H. Cornnell,1 Arig Ibrahim-Hashim,1 Kate Bailey,1 Yoganand Balagurunathan,1 Jennifer M. Rothberg,4 Bonnie F. Sloane,5 Joseph Johnson,3 Robert A Gatenby,1,2 and Robert J Gillies1,2
Author information Copyright and License information Disclaimer
1Department of Cancer Imaging and Metabolism; 12902 Magnolia Avenue; Tampa, Fl 33612
2Department of Radiology; 12902 Magnolia Avenue; Tampa, Fl 33612
3Department of Advanced Microscopy Laboratory H Lee Moffitt Cancer Center and Research Institute; 12902 Magnolia Avenue; Tampa, Fl 33612
4Cancer Biology Program, Wayne State University School of Medicine, Detroit, Michigan 48201
5Department of Pharmacology, Wayne State University School of Medicine, Detroit, Michigan 48201
Correspondence: Robert J. Gillies; gro.ttiffom@seilllig.trebor
*These authors contributed equally to this work
酸性细胞外微环境与癌症
Acidic extracellular microenvironment and cancer
加藤保正(Yasumasa Kato),通讯作者1小泽茂行(Shigeyuki Ozawa),宫本千寻(Chihiro Miyamoto)3,前田洋次郎(Yojiro Maehata),3铃木敦子(Atsuko Suzuki),前田丰信(Toonobubu)1和Yuh Baba 4
摘要
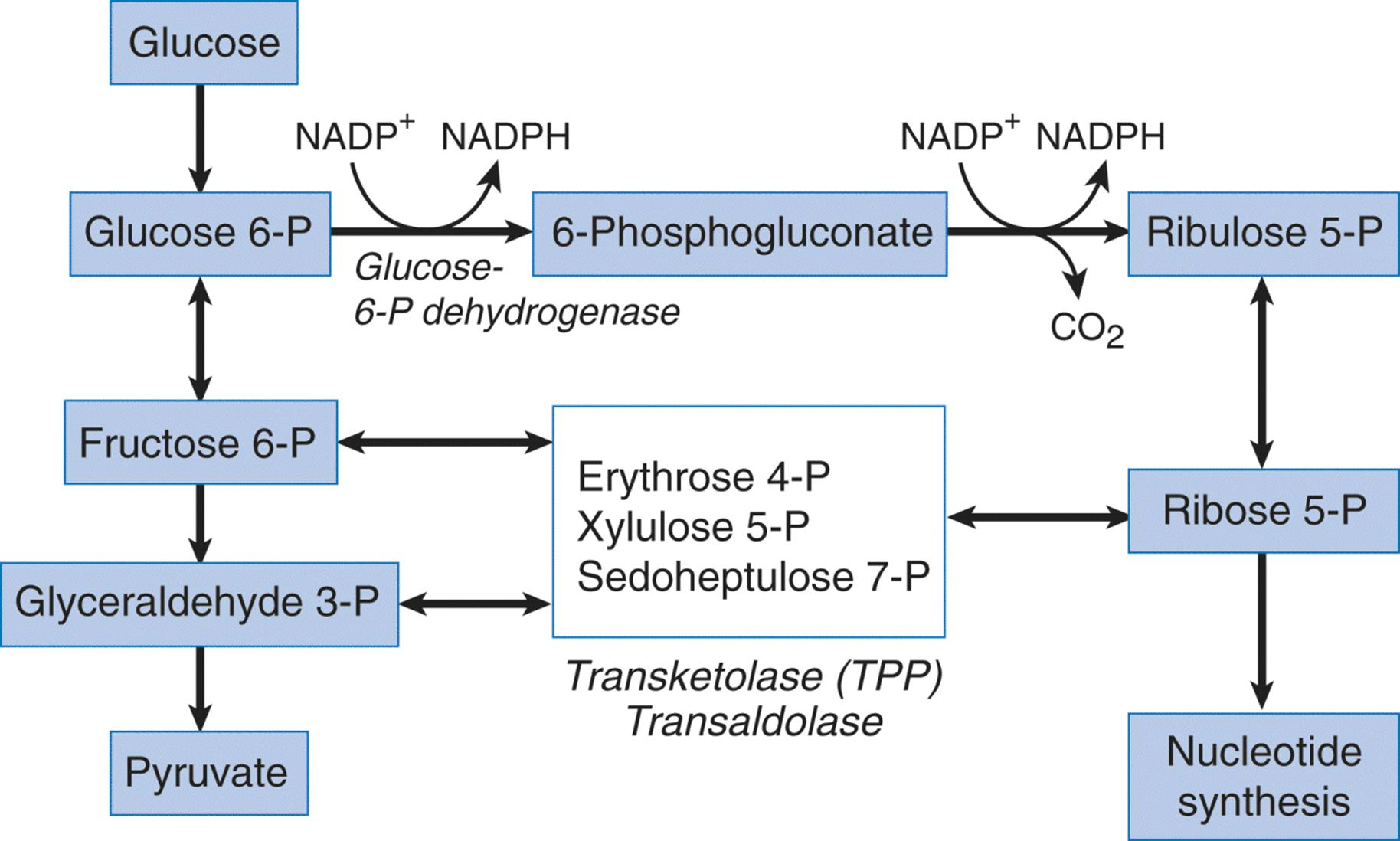
酸性细胞外pH是肿瘤组织的主要特征,细胞外酸化主要被认为是由于厌氧糖酵解分泌的乳酸。临床病理证据表明,转运蛋白和泵浦促进了H +的分泌,例如Na + / H +交换子,H +-乳酸共转运蛋白,单羧酸酯转运蛋白和质子泵(H + -ATPase)。这些也可能与肿瘤转移有关。酸性细胞外pH不仅激活分泌的溶酶体酶(在酸性范围内具有最佳pH),而且通过不同于低氧的细胞内信号级联反应诱导某些促转移因子基因的表达。除乳酸外,来自戊糖磷酸途径的CO2是酸度的另一种来源,表明缺氧和细胞外酸度彼此独立,与细胞微环境密切相关。在本文中,回顾了酸性细胞外pH作为参与肿瘤进展的微环境因子的重要性。
关键字:酸性微环境,癌症,恶性表型Acidic extracellular microenvironment and cancer
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3849184/
肿瘤代谢和肿瘤微环境中的有氧糖酵解和高乳酸水平
Aerobic glycolysis and high level of lactate in cancer metabolism and microenvironment
Bo Jiang Department of Oncology, Avis General Hospital, Beijing, ChinaMetabolic abnormalities is a hallmark of cancer. About 100 years ago, Nobel laureate Otto Heinrich Warburg first described high rate of glycolysis in cancer cells. Recently more and more novel opinions about cancer metabolism supplement to this hypothesis, consist of glucose uptake, lactic acid generation and secretion, acidification of the microenvironment and cancer immune evasion. Here we briefly review metabolic pathways generating lactate, and discuss the function of higher lactic acid in cancer microenvironments.
介绍
肿瘤由多种细胞类型组成,周围的微环境支持癌细胞的生长,迁移,侵袭和转移。不同的癌细胞通过旁分泌和外泌体的交流共同进化。1、2癌细胞的代谢产物也会影响自身,同一类型微环境中的其他类型的癌细胞和免疫细胞。
代谢异常是癌症的标志。关于癌细胞代谢的越来越多的论文表明,有氧糖酵解抑制剂和其他针对代谢酶的新药物具有阻止癌症进展的巨大潜力。根据Warburg的假设,癌细胞选择有氧糖酵解作为葡萄糖代谢的主要方式,而不是更有效的氧化磷酸化。线粒体功能障碍,肿瘤抑制因子的丧失,低氧微环境以及癌基因驱动的代谢重编程是癌细胞异常能量代谢的起始事件。3在超过70%的人类癌症中,糖酵解基因普遍过量表达。4、5
有氧糖酵解每个葡萄糖分子仅产生2个ATP分子,这意味着癌细胞需要从微环境摄取更多的葡萄糖分子以满足能量需求,并且需要向微环境分泌更多的乳酸以维持细胞环境的动态平衡。因此,癌症的代谢与微环境有着密切的相互作用和联系。在本文中,讨论并分析了癌症代谢与癌症微环境之间的关系。
过表达的葡萄糖转运蛋白
通过促进葡萄糖通过质膜转运蛋白/溶质载体(GLUT / SLC2A)家族在质膜上的转运,使葡萄糖从微环境中吸收到细胞质中。 GLUT家族包含14种膜结合蛋白,名称从GLUT1至GLUT14。
葡萄糖摄取是癌细胞有氧糖酵解中的限速步骤。在缺氧条件下,癌细胞经常过度表达GLUT,尤其是GLUT1和GLUT3。肿瘤缺氧微环境导致包含过表达的HIF-1α和HIF-1β亚基的缺氧诱导因子(HIF)。 HIF-1已被证明可以激活癌细胞中的多个信号通路。在缺氧条件下,GLUT1水平随着mRNA和蛋白质水平的变化而增加。 HIF-1被认为是氧感应上调GLUT1的表达。缺氧可激活位于Glut-1基因5'端的增强子,并发现一个独特的顺式作用序列作为HIF-1结合位点,从而增加GLUT1的表达6。
缺氧微环境还会导致癌症相关的成纤维细胞(CAF)中NF-κB和缺氧诱导性1α(HIF-1α)途径的激活。基底样CAFs分泌与癌细胞膜上的c-met结合的肝细胞生长因子(HGF),然后上调葡萄糖转运蛋白的表达。7
GLUT1(Km = 6.9 mM)和GLUT3(Km = 1.8 mM)对葡萄糖都有很高的亲和力。8因此,癌细胞可以有效掠夺葡萄糖,降低肿瘤微环境中的葡萄糖浓度,9随后影响浸润的免疫细胞的功能。
乳酸的生物合成与分泌
Warburg效应表明癌细胞增强有氧糖酵解以产生能量并为大分子生物合成提供中间产物,包括核糖5磷酸,核苷酸的甘氨酸或脂质的甘油。增强的需氧糖酵解并不意味着需氧氧化,并且三羧酸(TCA)循环已被100%阻断。最近的研究报告说,线粒体在大多数癌症中的功能是完整的。10,11癌细胞还通过消耗丙酮酸和其他TCA循环中间体部分产生ATP。因此,Warburg效应实质上是最大的糖酵解速率和丙酮酸氧化速率之间不平衡的结果。12
在有氧糖酵解中,丙酮酸通过乳酸脱氢酶-A(LDHA)转化为乳酸。癌细胞中乳酸的积累促进了质子连接的单羧酸盐转运蛋白(MCT),尤其是MCT113和MCT4.14,15的乳酸转运。发现这些MCTs过度表达会加速乳酸从细胞质向细胞外液的分泌。它使肿瘤微环境中的pH降至6.6。16微环境的酸化主要是由癌细胞分泌的乳酸引起的。17MCT1抑制剂如a-氰基-4-OH-肉桂酸酯(CHC)或lonidamine有效在体内研究中可以抑制肿瘤的生长[18、19],并提高对放射治疗的敏感性。这意味着从癌症细胞质中输出的乳酸,以去除多余的碳并维持NAPDH +的储存,对肿瘤的生长非常重要。 MCT1,MCT4是潜在的癌症治疗靶标。
即使在常氧氧化肿瘤细胞中,乳酸也会激活血管内皮生长因子(VEGF)20、21,转化生长因子β(TGF beta),22白介素-1(IL-1)和HIF-1。如前所述,HIF-1是糖代谢过程中的关键调节因子。因此,较高的乳酸可以反馈以增强癌细胞中的糖酵解,引起恶性循环。较高的VEGF通过刺激内皮细胞迁移以及循环血管祖细胞的募集和血管形态发生进一步诱导肿瘤血管生成。
能源浪费和再利用
肿瘤由一系列连续的细胞亚群组成。低氧环境中的癌细胞消耗高水平的葡萄糖,利用有氧糖酵解作为改变的能量代谢途径,从细胞质中分泌高水平的乳酸。血管附近的癌细胞具有大量的氧气补充,优先利用乳酸作为其主要能源。因此,乳酸不是废物,它被重新用作能量载体,在不同癌症亚群之间转移能量。
已经描述了在癌症微环境中重复使用的三种乳酸模型:“反向Warburg效应”,代谢共生和血管内皮细胞穿梭。 “反向Warburg效应”是指癌细胞分泌过氧化氢以创建“伪低氧”环境,从而激活基质细胞的HIF-1α,糖酵解和MCT4表达。基质细胞的糖代谢转变为有氧糖酵解,并分泌乳酸至微环境,反过来,新产生的乳酸被癌症吸收为能量底物。代谢共生描述了乳酸作为媒介将能量从高度糖酵解的,低氧的癌细胞转移到更具氧化性的癌细胞。
微环境酸化和癌症免疫逃逸
已知抗癌免疫反应是由效应T细胞介导的,效应T细胞依赖于微环境中的辅助细胞和细胞因子。肿瘤免疫力还受到环境pH值的影响,微环境中的酸性pH可以显着减弱免疫细胞的反应。23微环境酸度对生理值的调节会逆转肿瘤浸润性T淋巴细胞的无能状态。24
有氧糖酵解也是激活T细胞产生能量的主要方法。25在T细胞活化过程中,T细胞通过上调糖酵解酶来增加葡萄糖摄取和糖酵解速率,糖酵解酶会产生更多的乳酸分泌到微环境中。肿瘤细胞导致的较低的pH值和较高的乳酸浓度会抑制T细胞的乳酸分泌,并导致T细胞被窒息,从而使增殖和细胞因子生成降低95%。26这些作用是由MAPK p38和JNK / c- T细胞的Jun磷酸化。
乳酸还通过下调LPS诱导的基因表达,延迟LPS诱导的AKT磷酸化和IKB降解来抑制先天免疫。 LPS刺激后与乳酸预孵育可显着降低TNF,IL-6 MCP-1,MIP-1a的分泌。这意味着较高的乳酸浓度可能起到抑制作用。
总结
癌细胞在葡萄糖代谢中具有明显的异质性。大多数癌细胞主要依赖有氧糖酵解,因为它占其ATP预算的56–63%。因此,癌细胞从微环境中掠夺更多的葡萄糖,并分泌更多的乳酸,以满足能量和物质代谢的需求。癌细胞的这种特征导致肿瘤微环境中的葡萄糖浓度降低和酸度升高,随后抑制了浸润的免疫细胞,有助于肿瘤的免疫逃逸。开发针对葡萄糖摄入,有氧糖酵解或癌细胞乳酸分泌的新药可能会产生双重影响:抑制肿瘤细胞并恢复免疫反应。Aerobic glycolysis and high level of lactate in cancer metabolism and microenvironment - ScienceDirect
https://www.sciencedirect.com/science/article/pii/S2352304217300107
.png)
.png)