维生素K与软组织钙化 骨钙素 钙平衡 甲状旁腺 高磷酸血症 缺氧诱导钙化 研究
维生素K1-来源于深绿色的蔬菜-凝血
维生素K2-来源于肠道细菌的发酵-防止软组织的钙化和把钙导向骨骼
维生素K的每日需要量
骨钙素需要维生素K才能激活
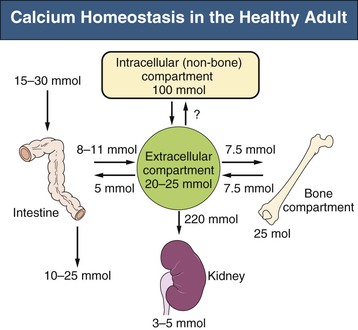
低血钙和高血钙-正常的血钙水平是超饱和水平
维生素K和维生素C-redox-cycles 治疗癌症
低ATP和ATP产生的焦磷酸导致钙沉积
镁和ATP协同抑制钙沉积-镁和ATP(三磷酸腺苷稳)定无定形磷酸钙

低血钙的信号:这种疾病的症状包括痉挛、抽搐、虚弱、食欲不振、手指和脚趾的刺痛感以及心律失常。
高血钙的信号:高尿钙、肾结石、血管和软组织钙化。
软组织钙化Soft Tissue Calcification
正如你所看到的,在实际的x线摄影实践中,几乎每个软组织中的钙化都是由营养不良的钙化引起的。这是什么意思?简单地说:当组织受到损伤时,身体会以一种非特异性的方式对这种损伤作出反应,这就是炎症反应。这有时会导致受损组织钙化。这种钙化通常仅在显微镜下可见,但偶尔也足以在放射学上看到
营养不良钙化意味着组织受损。任何伤害都可以。
As you can see, almost every calcification that one sees in the soft tissues in actual radiographic practice is due to dystrophic calcification. What does this mean? Simply this: when tissue is damaged, the body responds to this injury in a nonspecific manner by invoking the generic inflammatory response reaction. This sometimes ends with calcification of the damaged tissue. This calcification is probably usually only microscopic, but is occasionally enough to be seen radiographically.
Again, dystrophic calcification means damaged tissue. Any kind of damage will do.
Soft Tissue Calcifications
https://rad.washington.edu/about-us/academic-sections/musculoskeletal-radiology/teaching-materials/online-musculoskeletal-radiology-book/soft-tissue-calcifications/
服用华法林时,你应该每天摄入等量的维生素K。美国农业部建议成年人每天摄入90微克维生素k。
如果你今天只吃泡菜,罐头,固体和液体。你必须每天喝4.88杯才能摄入100%推荐的90微克维生素K。
同样,为了获得每日推荐维生素k摄入量的50%(45微克),你必须吃2.44杯泡菜、罐头、固体和液体。
此外,你还需要吃1.22杯酸菜、罐头、固体和液体,才能获得每日推荐维生素K的25%(22.5微克)。
维生素K的功能
人们普遍认为维生素K与凝血有关,存在于绿叶蔬菜中。这是K1。另一方面,维生素K2存在于纳豆、某些奶酪、蛋黄、某种富含维生素的黄油和泡菜中。纳豆K2含量极高,是一种粘稠、刺激性强的发酵大豆,深受日本人喜爱,可作为补充食品。K2有助于预防心脏病,支持骨骼健康,并可能有助于预防痴呆症。
将钙
我向我的病人解释的方式是,维生素D帮助你吸收钙,而维生素K2告诉你的身体应该把钙放在哪里——它应该放在骨头的哪里,而不是服务于心脏的脆弱的血管内壁。动脉钙化会导致心脏病发作。所以看起来鸡蛋、奶酪和黄油可能是心脏健康饮食的一部分,这与流行的教条相反。事实上,看起来饱和脂肪根本就不会引起心脏病。
饱和脂肪导致心脏病的观点看起来更像是一个松散的推论,因为饱和脂肪会增加胆固醇水平,而不是有确凿的科学证据证明它们会直接导致心脏病。
心灵和思想
荷兰一项广为宣传的研究——鹿特丹心脏研究——表明,大量食用Edam和Gouda奶酪的人体内维生素K2含量更高,动脉钙化也更少。维生素K2水平越高,患前列腺癌的风险也越低。通过阻止钙进入大脑,K2也可能有助于预防老年痴呆症。这里有一个明确的模式:在错误的地方摄入过多的钙会造成麻烦。适量的钙(骨头)是一件好事。维生素K2似乎可以确保钙以正确的数量进入正确的位置。
食物来源
尽管人类肠道内的细菌可以制造维生素K2,但许多人的肠道已经被多种剂量的抗生素、糟糕的食物以及身体和情感上的压力严重破坏,转化变得非常困难。另一方面,益生菌有助于重建健康的肠道细菌,因此可能支持肠道K2的合成。绿叶蔬菜中10-15%的K1转化为K2,但人类一天从各种来源吸收的K1不超过200微克,所以我们不能指望从新鲜的绿色蔬菜中满足我们所有的K2需求。此外,K1本身是更好地吸收时,吃与饮食脂肪。基本上只剩下发酵食品(纳豆和酸菜)和牧场饲养的动物食品(奶酪、蛋黄、黄油和肝脏)作为K2的来源。
得到K2
多吃绿叶蔬菜,配上橄榄油或黄油,大部分时间吃几盎司奶酪,用乳酸发酵的酸菜作为调味品,每周吃几个鸡蛋,你可能就摄取了足够的K2——鹿特丹心脏研究建议的大约每天37微克。想要一个以食物为基础的K2保险吗?加入两粒蓝冰发酵鱼肝油胶囊和牛油。这是一种含有K2的牛油,牛油来自于生长在中西部深黑草原表层土壤上的草。或者你也可以自己取黄油油。你也可以加入一些真正的纳豆,但你的味蕾可能会承受不了。或者你可以服用一种补充剂——纳豆或K2——但为什么不从食物中获得你所需要的东西呢?不管怎样,一定要得到K2。
Dr. Alan Inglis | Ignore Vitamin K2 at your peril | Politically Incorrect
Medicine
https://americancountrymd.com/ignore-vitamin-k2-at-your-peril/
优化维生素K摄取的最大原因 Dr.Mercola
故事大致
维生素K1是负责凝血的维生素K的主要形式
维生素K2对骨骼强度、动脉和血管的健康至关重要
维生素K2缺乏还与胰岛素抵抗、糖尿病、类风湿关节炎有关,并可能增加患某些癌症的风险
维生素K2含量高的食物包括生乳制品,如某些奶酪、生黄油和开菲尔酒,以及纳豆和发酵蔬菜,如酸菜
Mercola博士
虽然维生素D的重要性已得到充分认识,但另一种与维生素D同样重要的维生素,维生素K2,需要得到更广泛的承认。它是一种脂溶性维生素,因其在血液凝固中的作用而广为人知。
然而,有两种主要的维生素K,它们的功能非常不同。
维生素K1是负责凝血的维生素K的主要形式,而维生素K2对骨骼强度、动脉和血管的健康至关重要,并在其他生物过程中发挥作用,包括组织更新和细胞生长。
在2014年发表的论文《维生素K:新视角下的旧维生素》中,维生素D专家迈克尔·霍利克博士和合著者回顾了维生素K的历史及其诸多益处,包括它对骨骼和心血管健康的重要性。他们还讨论了重要的药物相互作用。
维生素K1和K2不能互换
维生素K1和K2之间的差异最早是在鹿特丹研究中发现的,该研究发表于2004年。多种食物的维生素K含量都得到了测定,在绿叶蔬菜中发现了大量的维生素K1,如菠菜、甘蓝、西兰花和卷心菜。
另一方面,维生素K2只存在于发酵食品中。它是由某些细菌在发酵过程中产生的。有趣的是,虽然蔬菜中的K1吸收不良,但实际上发酵食品中的所有K2都很容易进入你的身体。
维生素K2含量高的食物包括生乳制品,如某些奶酪、生黄油和开菲尔酒,以及纳豆(一种发酵豆制品)和发酵蔬菜,如酸菜。
然而,并不是所有的细菌都能产生K2,所以并不是所有的发酵食品都含有K2。例如,巴氏杀菌乳制品和来自限制动物饲养操作(CAFOs)的产品K2不高,应该避免。只有草食动物(不是谷物饲料)才会自然生长出高K2水平。
大多数商业酸奶实际上都不含维生素K2,而某些类型的奶酪,如豪达奶酪、布里奶酪和Edam奶酪的K2含量很高,而其他类型的奶酪则不含。这取决于发酵过程中存在的特定细菌。
我发现的最好的来源之一就是用一种特殊的发酵剂来发酵你自己的蔬菜,这种发酵剂是用能够产生维生素K2的菌株设计的。
我的研究团队发现,我们可以从一份两盎司的发酵蔬菜中获得400至500微克(mcg)的维生素K2,这是一种临床治疗剂量。
最好的是,如果您使用这种入门文化,它是绝对免费的。如果你想了解更多关于用发酵剂制作你自己的发酵蔬菜的知识,你可以观看视频并在这个页面上阅读更多。
维生素K2的亚类
维生素K2可以分为两类:
维生素K2的一种短链形式,存在于黄油、蛋黄和动物性食品中。
避免使用补充形式,因为只有合成形式可用。MK-4的生物半衰期也很短,大约只有一个小时,因此作为一种膳食补充剂并不理想。
MK-7 (menaquinone-7),在发酵食品中发现的长链形式。这些长链形式有很多种,但最常见的是MK-7。
这是你想在补充剂中寻找的一种,因为这种形式是从真正的食物中提取的,特别是纳豆,一种发酵的豆制品。实际上,你可以从纳豆中获得大量的MK-7,纳豆相对便宜,在大多数亚洲食品市场都可以买到。
在发酵过程中形成的MK-7有两个主要优点。它在你体内停留的时间更长,半衰期也更长,这意味着你可以每天服用一次,剂量也很方便。
研究3表明,MK-7通过抑制一种叫做单核细胞的白细胞产生的促炎症标志物来帮助预防炎症。
.jpg)
维生素K2缺乏对健康的影响
维生素K2是维生素D的重要辅助成分,没有它维生素D就不能正常工作。K2的生物活动也会因为缺乏维生素D而受损,所以你真的需要把这两种营养结合起来考虑。
这意味着,如果你服用高剂量的口服维生素D,你需要记住也要从食物或MK-7补充剂中增加维生素K2的摄入量。如果做不到这一点,可能会造成伤害,因为没有K2,你的身体将无法完成钙的运输到适当的区域,动脉钙化可能会开始。
如果你的维生素D主要来自阳光照射,那么这个问题基本上是可以避免的,因为你的身体可以调节它的维生素D的生产。你不能因为晒太阳而过量摄入维生素D。
维生素D和K2也与镁和钙协同作用,所以这四种维生素最好是同时服用。不幸的是,大多数人都缺乏维生素D和K,镁不足也很常见。
至少50%的普通人群维生素D缺乏和不足的风险,和多达97%可能缺乏维生素K2.4这很可能是由于这样的事实,我们停止吃发酵食品随着制冷和其它食品加工技术。
虽然你可能从饮食中获得足够的维生素K来维持足够的血液凝块,但你可能没有获得足够的维生素K来保护你免受与维生素K2更具体相关的各种其他健康问题的影响,比如:
动脉钙化和心血管疾病
骨质疏松症
白血病和肺癌,5前列腺癌,6肝癌
神经缺陷,包括痴呆
传染病,如肺炎
注意:他汀类药物可能会耗尽维生素K2
除了缺乏维生素K2的饮食,某些药物可能会影响你的维生素K2状态。发表在《美国心脏病学会杂志》上的研究表明,他汀类药物可能会增加动脉钙化,而其他研究表明,他汀类药物会耗尽维生素K2。
您可能知道,他汀类药物使用者需要服用CoQ10(或泛素),因为药物会耗尽这种营养,但他们也可能需要维生素K2,以避免与他汀类药物相关的心血管风险。
为什么维生素K对心血管健康至关重要
在20世纪80年代,人们发现需要维生素K来激活骨钙蛋白,而骨钙蛋白存在于骨骼中。大约十年后,另一种依赖维生素k的蛋白质被发现:基质Gla蛋白(MGP),在你的血管系统中发现。
如果没有维生素K,这些和其他依赖维生素K的蛋白质就会失去活性,无法发挥它们的生物学功能。另一个重要的发现是MGP能强烈抑制钙化。当MGP处于失活状态时,你最终会出现严重的动脉钙化,这就是维生素K对心血管健康如此重要的原因。有证据表明维生素K甚至可以逆转由维生素K缺乏引起的动脉钙化。
维生素K2还有助于防止动脉钙化,因为它把钙从不该在的地方(在血管内壁)转移到真正需要的地方(比如在骨头里)。在鹿特丹10年的研究中,那些摄入最多K2的人患心血管疾病、心血管钙化的风险最低,死于心血管疾病的几率也最低。
每天摄入45微克K2的人比每天摄入12微克的人多活7年。这是一个意义深远的发现,因为K1摄入量不存在这种相关性。在随后的一项名为前景研究的试验中,11万6千人被跟踪了10年。在这里,他们发现饮食中每增加10微克K2,心脏事件就会减少9%。
最近,发表在《血栓和止血》杂志上的一项研究发现,补充MK-7可以改善健康绝经后妇女的动脉硬化。这项研究被称赞为具有重要意义,因为尽管之前的研究只能证明两者之间存在关联,但这是首次证实长期服用MK-7形式的维生素K2确实能改善心血管健康。
维生素K2对预防骨质疏松症至关重要
如前所述,维生素K2在骨骼健康中也起着至关重要的作用,可能对预防骨质疏松症至关重要。骨钙素是由成骨细胞(负责骨形成的细胞)产生的一种蛋白质,作为骨形成过程中不可或缺的一部分在骨内使用。然而,骨钙素必须“羧化”才能有效。维生素K作为一种辅酶的功能,催化骨钙素的羧化酶。
日本的一些试验表明,维生素K2完全逆转骨质流失,在某些情况下甚至会增加骨质疏松症患者的骨量。14日本七项试验的综合证据还表明,补充维生素K2可使椎体骨折减少60%,使髋关节和其他非椎体骨折减少80%
中国最近对19项随机对照试验的荟萃分析发现,补充维生素K2可显著改善绝经后妇女的椎体骨密度,并降低骨折的风险。
另一个三年的长安慰剂对照study17在荷兰发现绝经后妇女每天服用180微克的MK-7增加骨强度,看到降低老年性骨质下降的速率和降低骨质密度,相比服用安慰剂。下面这张图摘自霍利克博士2014年发表的维生素K2论文《维生素K对骨骼和血管健康的影响》。
你有足够的维生素K吗?
很明显,你需要维生素K1和K2,但是你的饮食中几乎肯定得不到足够的K2除非你吃适当的发酵食品。维生素K1的饮食来源包括:
羽衣甘蓝
菠菜
羽衣甘蓝
西兰花
球芽甘蓝
至于临床上有用的维生素K2剂量,包括鹿特丹25号研究在内的一些研究表明,每天只需45微克就足够了。一般来说,我建议每天摄入150微克的维生素K2。其他人则建议稍微高一些;超过180至200微克。你可以通过每天吃15克纳豆(半盎司)或发酵蔬菜来获得健康的K2含量(约200微克)。如果你用含有产生维生素k2的细菌的发酵剂来发酵它们,一盎司可以提供200到250微克。
如果你选择维生素K2补充剂,确保它是MK-7。同时记住要和脂肪一起服用,因为它是脂溶性的,否则不会被吸收。幸运的是,你不需要担心K2的过量,因为它似乎是完全无毒的。在过去的三年里,人们服用了上千倍的“过量”药物,没有出现任何不良反应。,没有增加凝血倾向)。
也就是说,服用维生素K拮抗剂的人,即通过减少维生素K的作用来减少血凝块的药物,应避免服用MK-7补充剂。最后一个建议,记住维生素K2本身不一定能让你“感觉更好”。它的内部工作原理是这样的,你不太可能感觉到身体上的不同。因此,依从性可能是一个问题,因为人们更有可能采取具有明显效果的措施。这可能不会发生在维生素K2上,但这并不意味着它没有任何作用。
Top Reasons to Optimize Your Vitamin K2
https://articles.mercola.com/sites/articles/archive/2015/10/05/benefits-vitamin-k2.aspx
含Gla丰富的蛋白是一种新型的维生素K依赖蛋白,存在于血清中,在病理钙化部位积累
软组织矿化是一种异常的过程,发生在任何身体组织,可以大大增加发病率和死亡率。维生素k依赖(VKD)蛋白在这些过程中起着重要作用;基质Gla蛋白被认为是迄今为止已知的最相关的软组织钙化的生理抑制剂之一。一些研究表明,其他未知的VKD蛋白也可能参与软组织钙化的病理过程。我们最近在鲟鱼中发现了一种新的VKD蛋白,富含Gla-蛋白
(GRP),其中Gla残基的数量与成熟蛋白的大小之比是目前发现的最高的。虽然GRP主要在鲟鱼软骨组织中表达,但在大鼠软骨和骨中均存在GRP。我们现在表明,GRP是一种循环蛋白,也表达了和积累在老鼠和人类的软组织,包括皮肤和血管系统,当受到病理性钙化,GRP积累在高浓度矿物沉积的网站,指示一个协会和钙化过程。大量的Gla残基及其与矿物的结合亲和特性表明,GRP可能直接影响矿物的形成,从而在结缔组织矿化过程中发挥作用。
Gla-Rich Protein Is a Novel Vitamin K-Dependent Protein Present in Serum That
Accumulates at Sites of Pathological Calcifications
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2789615/
维生素K在软组织钙化中的作用
迄今已鉴定出17种维生素k依赖蛋白,其中一些蛋白参与调节软组织钙化。骨钙素、基质Gla蛋白(MGP)、可能还有富含glao的蛋白都是软组织钙化的抑制剂,需要维生素k依赖的羧化作用才能发挥作用。它们的一个共同特点是分子量小,人们认为它们的体积小是抑制组织内钙化的关键。MGP是由血管平滑肌细胞合成的,是目前已知的最重要的动脉矿化抑制剂。值得注意的是,上述肝外Gla蛋白在健康成年人群中仅部分羧化,提示维生素K不足。由于最基本的Gla蛋白的羧化作用定位于肝脏,而非最基本的Gla蛋白则定位于肝外组织,因此,在维生素K受到限制时,一种运输系统的进化确保了膳食维生素K优先分配到肝脏。这就是为什么维生素K不足的最初症状被认为是肝外Gla蛋白的羧化不足。研制了一种新的无羧基MGP循环构象特异性分析方法;一种去磷无羧化基质Gla蛋白的测定方法,另一种总无羧化基质Gla蛋白的测定方法。循环去磷-非羧化基质Gla蛋白可预测心血管风险和死亡率,而循环总非羧化基质Gla蛋白与动脉钙化程度有关。维生素K干预研究表明,MGP羧化可以剂量依赖性地增加,但迄今为止只有1项具有临床终点的研究完成。这项研究表明,在3-y补充期间,血管弹性保持不变,而安慰剂组的弹性降低了12%。在得出结论之前,需要对健康受试者和有血管钙化风险的患者进行更多的研究。
导论
在脊椎动物中,所有细胞外体液过饱和钙和磷酸盐,导致自发磷酸钙沉淀的趋势,通常表示为钙×(1)无机磷酸盐产品。强有力的抑制剂的钙盐沉淀和结晶因此必不可少的生存,因此广泛的低和高分子量抑制剂在循环。低分子量抑制剂包括焦磷酸盐和柠檬酸盐,而最有效的抑制剂是中小型蛋白质。
胎蛋白a是一种在肝脏中合成并分泌到血液循环中的48-kD蛋白;它是软组织钙化最重要的全身抑制剂。转基因胎蛋白a缺乏的小鼠表现为严重的弥漫性全身钙化表型,大多数组织中均可见点状钙化灶(2)。例如骨钙素(OC),也称为骨Gla蛋白,基质Gla蛋白(MGP),可能还有新发现的富含glao的蛋白(GRP),它们都是介于5到∼10kd之间的蛋白。与胎蛋白a相反,这些蛋白是局部的钙化抑制剂,即它们是在发挥功能的组织中合成的。OC是合成骨的成骨细胞,转基因小鼠OC-deficient展示(3)骨矿物质含量增加。MGP主要是由软骨细胞和血管平滑肌细胞合成和MGP-deficient小鼠受损的增长(过度生长板钙化引起的)和大量钙化的动脉中模(4)。一个有趣的问题是为什么fetuin-A单独是无法阻止这些组织钙化。最近,提出了一个假说,为这个问题提供了一个可能的答案。Price等人(5)在他们的论文中证明,胎蛋白- a分子质量为48kd,体积过大,无法穿透胶原蛋白和弹性蛋白原纤维的腔隙。但如果没有其他抑制剂存在,这些纤维将迅速钙化。只有小到足以穿透胶原蛋白和弹性蛋白原纤维的钙化抑制剂,即, OC和MGP,将能够自由地进入纤维,并防止内部的矿物生长。这就解释了弹力蛋白原纤维容易钙化的原因,特别是在维生素K不足时,并说明了维生素K在预防软组织钙化中的重要作用。
The Role of Vitamin K in Soft-Tissue Calcification
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3648717/
维生素K和骨钙素(osteocalcin)
骨钙素,也被称为骨-羧谷氨酸含蛋白(BGLAP),是一种在骨和牙本质中发现的非胶原蛋白激素,最初在鸡骨骼中被确定为钙结合蛋白
由于骨钙素具有gla结构域,其合成依赖于维生素K。在人类中,骨钙素是由BGLAP基因编码的。它的受体包括GPRC6A,
GPR158,可能还有第三种尚未被识别的受体
骨钙素(osteocalcin)仅由成骨细胞分泌,被认为在身体的代谢调节中发挥作用。[10]以其羧基化的形式直接与钙结合,因此集中在骨骼中,但遗传证据表明,它在骨骼矿化中没有发挥重要作用。
骨钙素以其非羧化形式在体内发挥激素的作用,在胰腺、脂肪、肌肉、睾丸和大脑中发出信号
在胰腺,骨钙素作用于细胞,导致胰腺细胞释放更多的胰岛素
在脂肪细胞中,骨钙素触发激素脂联素的释放,从而增加对胰岛素的敏感性
在肌肉中,骨钙素作用于肌细胞,促进能量的利用和利用,这种方式有利于锻炼能力
在睾丸中,骨钙素作用于睾丸间质细胞,刺激睾丸激素的生物合成,从而影响男性生育能力
在大脑中,骨钙素在发育和功能中起着重要的作用
急性应激反应(ASR)(俗称“战斗或逃跑反应”)会在几分钟内刺激小鼠、大鼠和人类的骨钙素释放。在肾上腺功能不全的情况下,仅注射高水平的骨钙素就能触发ASR
用作骨形成的生化指标
骨钙素是由成骨细胞产生的,常被用作骨形成过程的标志物。已有研究表明,血清骨钙素水平升高与骨质疏松症合成代谢骨形成药物(如特瑞帕拉肽)治疗期间骨密度的增加相关较好。在许多研究中,骨钙素被用来作为一种初步的生物标志物,以确定特定药物对骨形成的有效性。例如,有一项研究旨在研究一种名为乳铁蛋白的糖蛋白对骨形成的影响,该研究使用骨钙素作为成骨细胞活性的测量指标。
Osteocalcin - Wikipedia
https://en.wikipedia.org/wiki/Osteocalcin
骨钙素(OSTEOCALCIN)代谢功能综述
An overview of the metabolic functions of osteocalcin
最近骨生物学的一个意想不到的发展是,骨是一个内分泌器官,有助于调节一系列的生理过程。骨钙素是一种成骨细胞特有的激素,其功能之一是葡萄糖稳态。在这篇综述中,我们解释了为什么我们假设骨量和能量代谢之间应该有一个协调的内分泌调节的理论基础。然后,我们回顾了骨钙素内分泌功能的实验,以及骨钙素成为激素的细胞生物学事件。我们也证明了这一调控对理解机体在生理状态和病理状态下的葡萄糖稳态的重要性。最后,我们讨论了流行病学和遗传学证据,证明骨钙素的这种功能是保存在人类。
关键词:成骨细胞,能量代谢,骨钙素
An overview of the metabolic functions of osteocalcin
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4499327/
骨钙素:一种成骨细胞来源的多肽激素,调节全身能量代谢。
布伦南-斯佩朗莎TC1,针叶树墓广告。
作者信息
1
澳大利亚新南威尔士州悉尼大学医学科学院生理学与博世研究所,悉尼,2006,tara.speranza@sydney.edu.au。
摘要
骨钙素是一种骨特异性蛋白,在临床中经常被用作骨转换的血清标志物。最近的证据表明,骨钙素在控制能量代谢方面发挥了以前没有被怀疑的作用。因此,骨钙蛋白缺乏的小鼠具有严重紊乱的代谢表型,包括胰岛素抵抗、葡萄糖耐受不良和异常脂肪沉积。此外,骨钙素给药可提高小鼠胰岛素敏感性,降低脂肪垫质量和血清甘油三酯水平。骨钙素在人体大量营养素代谢中的作用尚不清楚,但最近的研究报告显示,血清骨钙素水平与已建立的代谢健康指标之间存在正相关。本文综述了骨钙素的主要生理功能,重点讨论了骨钙素在调节大量营养素代谢、男性生殖功能和胎儿脑发育中的作用。我们考虑这些发现对协调新陈代谢与发育和生育的影响。我们还考虑了C类g蛋白偶联受体作为骨钙素受体的证据。
Osteocalcin: an osteoblast-derived polypeptide hormone that modulates whole
body energy metabolism. - PubMed - NCBI
https://www.ncbi.nlm.nih.gov/pubmed/25416346
骨骼能量代谢的调节:骨钙素等。
骨骼最近被发现是一种内分泌器官,参与调节葡萄糖和能量代谢。骨的这一功能至少在一定程度上是由骨钙素介导的,骨钙素是一种成骨细胞来源的蛋白,它作为一种激素,刺激胰岛素敏感性、胰岛素分泌和能量消耗。骨钙素的分泌和生物活性反过来又受到多种激素的调控,包括胰岛素、瘦素、交感神经系统和糖皮质激素。最近的研究结果支持骨钙素功能和调节在小鼠和人类之间是守恒的这一观点。此外,对小鼠的研究表明,骨钙素可能是治疗肥胖和胰岛素抵抗的一种可行的治疗方法。本文就骨钙素的功能、多种作用方式及其调控机制的研究进展作一综述。
Regulation of energy metabolism by the skeleton: osteocalcin and beyond. -
PubMed - NCBI
https://www.ncbi.nlm.nih.gov/pubmed/24893146
成骨细胞:控制葡萄糖稳态的胰岛素靶细胞。
在过去的五年里,骨骼在整个机体生理学中发挥了意想不到的作用,并被发现。在这些新描述的任务中,骨在控制能量代谢中的作用是通过骨钙素的分泌来实现的,骨钙素是一种成骨细胞产生的调节胰岛素分泌、胰岛素敏感性和能量消耗的激素。这些初步发现提出了几个关于骨中胰岛素作用本质的基本问题。我们两组独立的发现最近为其中一些问题提供了答案。通过对成骨细胞中缺乏胰岛素受体(InsR)的小鼠的分析,我们发现这些细胞中的胰岛素信号有利于全身葡萄糖稳态。重要的是,成骨细胞胰岛素信号的这一功能是通过骨钙素羧化和生物利用度的负调控实现的。我们的研究还证实,成骨细胞中的胰岛素信号不仅是一种正调控因子,对产后骨获得和骨吸收也有积极作用。有趣的是,成骨细胞中的胰岛素信号通过刺激破骨细胞活性而诱导骨钙素活化。事实上,骨吸收过程中产生的低pH值是脱羧骨钙素的充分手段。我们的研究结果表明成骨细胞是胰岛素控制全身葡萄糖稳态的重要靶点,骨吸收是调节骨钙素活化的机制。
美国骨与矿物研究学会版权所有
The osteoblast: an insulin target cell controlling glucose homeostasis. -
PubMed - NCBI
https://www.ncbi.nlm.nih.gov/pubmed/21433069
骨钙素的内分泌作用
Endocrine Actions of Osteocalcin
骨钙素是骨基质中最丰富的非胶原蛋白。一旦转录完成,该蛋白在分泌前在成骨细胞内经历翻译后修饰,包括谷氨酸中三个谷氨酸残基的羧化,这对于羟基磷灰石结合和沉积在骨细胞外基质中至关重要。最近对小鼠进行的实验观察显示,骨钙素的低羧化部分循环增加了男性和女性的胰岛素分泌和敏感性,降低了血糖,降低了内脏脂肪,同时提高了男性睾丸激素的分泌。此外,总骨钙蛋白和低羧化骨钙蛋白在体力活动后均增加,对葡萄糖耐量具有潜在的积极影响。尽管这些证据仅在人类中得到部分证实,但仍需要进一步的前瞻性研究来确定骨钙素在普通人群和糖尿病或其他代谢紊乱患者群体中的内分泌作用。
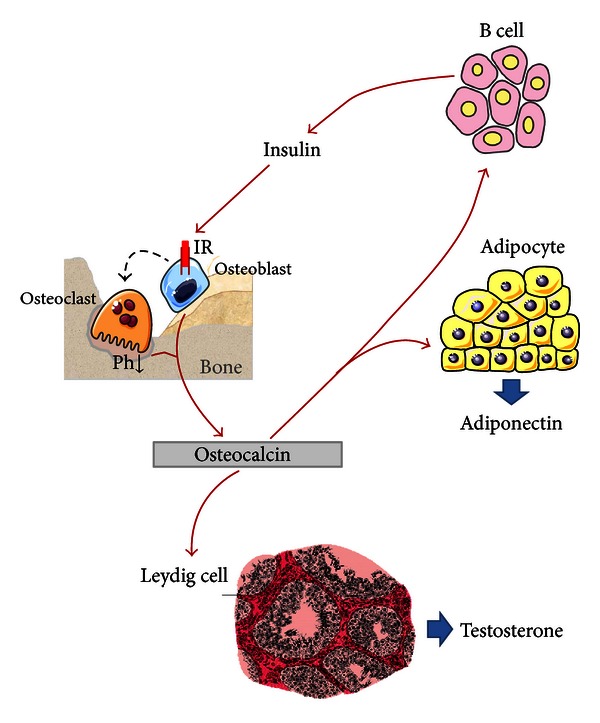
图2
骨钙素的内分泌作用。循环骨钙素,尤其是其undercarboxylated低羧化骨钙素(骨吸收活跃期间发布)施加直接影响β细胞,促进胰岛素的分泌以及脂肪细胞增强脂联素的生产。脂联素本身能够促进胰岛素敏感性。反过来,胰岛素也直接作用于成骨细胞,间接作用于破骨细胞。破骨细胞刺激骨吸收,随后在血液循环中释放低羧化骨钙素(undercarboxylated骨钙素)。最后,骨钙素对间质细胞也有作用,增加它们的活性和睾酮的产生。
Endocrine Actions of Osteocalcin
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3657394/
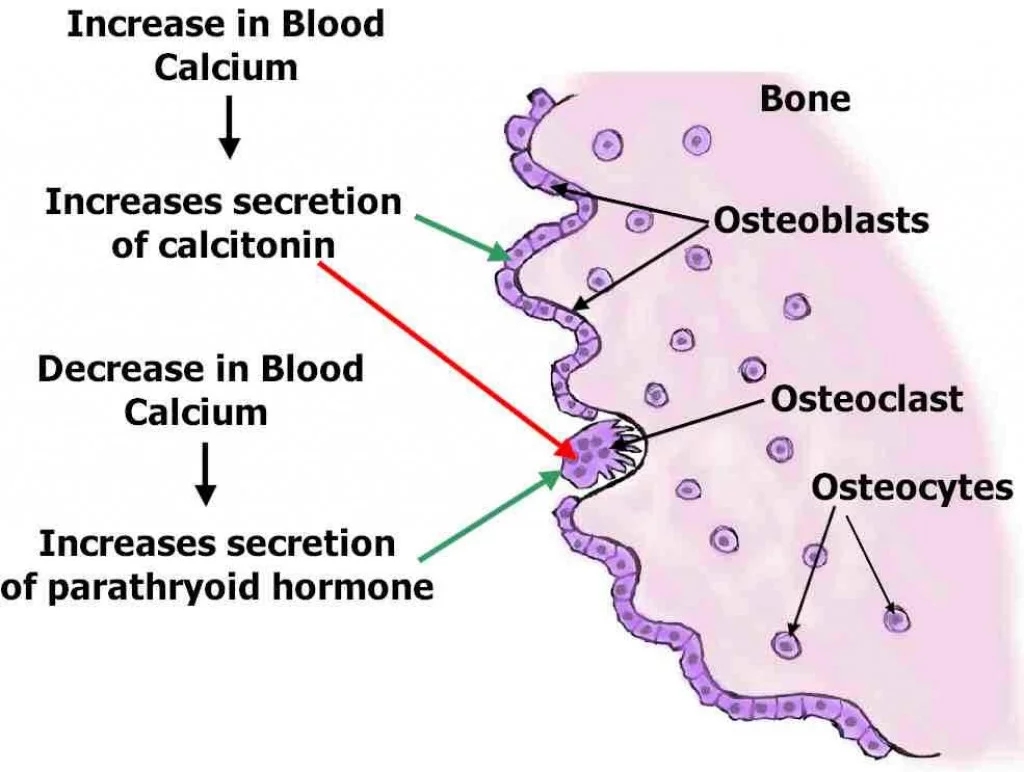
骨重建单元BONE REMODELING UNIT
骨重塑单元(BRU)或基本多细胞单元(BMU)被定义为一组骨细胞,它们移除并替换一个骨结构单元(骨on或hemiosteon)(参见图13-12)。BMU被理论化为促进骨微观结构调整的单位,以保持最大应变在一个“设定值”(Martin,
2007)。该单元有六个连续的阶段:(1)静息(正常表面的80%-95%);(2)活化,包括破骨细胞的募集和骨内膜细胞的收缩;(3)破骨细胞在松质骨Howship
's lacunae的吸收,或皮质骨的“切割锥”;(4)逆转,指骨吸收完成到骨基质形成开始之间1 ~ 2周的时间间隔;(5)骨基质的形成与矿化,矿化完成约需3
~ 6个月;(6)恢复休息。
成骨细胞产生集落刺激因子,增加来自骨髓前体的破骨细胞数量。破骨细胞受许多因素的调控,但最后两个效应因子是骨保护素(OPG/RANK)和OPG配体(RANKL)。均由成骨细胞谱系分泌,RANK-
l刺激破骨细胞分化和成熟破骨细胞活性,抑制破骨细胞凋亡和RANK具有相反的生物学效应(Jee,
2001)。因此,在微环境中,破骨细胞池可能受到RANK-RANKL比值的调控。破骨细胞附着在类骨细胞上,骨内膜细胞必须收缩并分泌胶原酶,以去除未矿化基质的表层;这些细胞识别吸收部位,并在从循环中招募破骨细胞前体和增强其分化中发挥作用。破骨细胞利用其细胞质中称为透明区(clear
zone)的区域附着在选定的吸收部位的周围,透明区没有细胞器,与局部环境隔离。其中,再吸收表面质膜的“皱褶边”通过一个产生氢离子的质子泵(pH
2-3)降低pH值,各种蛋白水解酶,包括MMPs,分泌到再吸收基质和骨细胞中。突起破骨细胞释放TGF-β,促进成骨细胞的成熟。破骨细胞表达降钙素和维甲酸受体,降钙素抑制吸收。它们对PTH的反应是由成骨细胞介导的,1,25(OH2)维生素D是刺激破骨细胞前体分化的另一个因素。破骨细胞的寿命被认为可达7周,当吸收完成时发生凋亡。
在皮质骨中,“切割锥”破骨细胞通过隧道进入基质(见图13-12),而在松质骨中,骨小梁表面发生吸收,直接去除旧骨,然后用新基质填充空腔。在小梁中也可以看到切割锥。皮质骨的再吸收的空腔直径大约200μm,可以穿过骨头的速度每天40μm(泰勒et
al ., 2007);蛀牙等年轻的纯种马,曾被观察到后者近似直径和推进的速度每天11μm
(Boyde和弗斯,2005)。正如上文所述,修复和置换与先前的破骨细胞吸收是位点耦合的,这已被广泛接受,但运动诱导的新骨附着可以发生在马的Mc3和Mt3骨骺小梁上,而不会发生中间的再吸收事件(Boyde,
2003)。
活性成骨细胞在骨吸收和逆转阶段后,在既存骨样上合成骨基质,矿化发生在既存骨样和新形成骨样的交界处,即矿化前沿。成骨矿化滞后于基质形成约10天,可见未矿化基质骨样缝。在编织骨中,矿化滞后时间很短,煤层不是不明显就是很薄。原生矿化使矿物密度在几天内增加到最大值的70%左右,而次生矿化则在几个月内增加到90%到95%。成骨细胞在成骨阶段结束时,可(1)转化为(不活跃的)骨衬细胞,(2)凋亡,(3)转化为形成软骨样基质的细胞,或(4)作为骨细胞嵌入到腔隙中新合成的类骨质中。每一种情况下成骨细胞的比例随年龄、物种和骨类型的不同而不同。
Bone Remodeling Unit - an overview | ScienceDirect Topics
https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/bone-remodeling-unit
骨重建的组织形态学分析
邓普斯特,《骨生物学原理》(第三版),2008
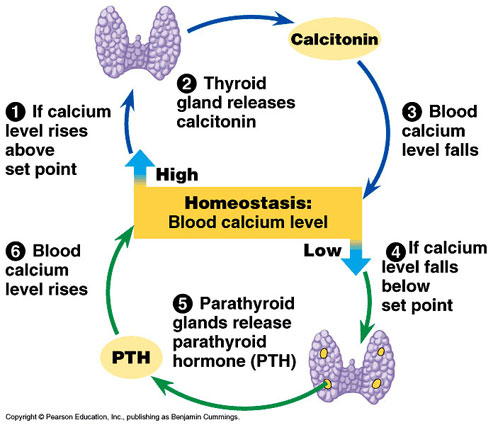
甲状旁腺功能亢进
循环甲状旁腺激素(PTH)水平的增加增加了骨重塑单元的激活频率,导致破骨细胞和成骨细胞数量的增加。因此,对原发性或继发性甲状旁腺功能亢进患者活检的组织形态学分析显示,侵蚀面、骨样面和矿化面增加(见图22.4)(Melsen
et al.,
1983;马鲁什和福格尔,1987年;巴黎人等,1990;西尔弗伯格等人,1990)。矿化面增大,但矿物配位率略有降低。然而,矿化面增加过度补偿了矿物配位率的降低,从而使这两个变量的乘积骨形成率增加。甲状旁腺功能亢进合并维生素D不足的患者骨周转率较高(Silverberg等,1990)。原发性甲状旁腺功能亢进患者保留松质骨体积和小梁连接(Parisien
et al., 1992)。骨周转率升高常常伴随着未成熟(编织)骨和骨髓纤维化的增加,特别是在严重继发性甲状旁腺功能亢进的病例中。
由于活组织检查反映了过度重塑活动的长期影响(例如,侵蚀面增加),它可以作为甲状旁腺亢进的敏感指标,尤其是在轻度或间歇性亢进时。然而,仅凭活组织检查无法区分原发性和继发性甲状旁腺功能亢进。
Bone Remodeling Unit - an overview | ScienceDirect Topics
https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/bone-remodeling-unit
一个好与坏的故事:细胞衰老在骨骼稳态和疾病
刘晓楠,万美,《细胞与分子生物学国际综述》,2019
与年龄有关的骨质疏松症
成年骨骼在一生中不断进行重塑,每10年更新一次骨骼(Crane and Cao, 2014;Lee等,2017;Seeman,
2009;唐等,2009;吴等,2010)。骨重塑是破骨细胞和成骨细胞在同一骨重塑单元中依次发生作用的过程。年龄相关的骨丢失,是由破骨细胞骨吸收活性增加和成骨细胞骨形成减少引起的,影响男女(Seeman,
2002;Rachner等,2011)。然而,在女性中,由于雌激素水平的迅速下降,绝经后骨质流失会加速5-10年;在这一阶段之后,骨丢失继续以与老年男性大致相同的速度进行,这表明骨细胞/骨髓微环境的老化过程是老年女性和男性骨丢失的一个常见原因。
世界上许多国家的人口老龄化带来了重大的医疗保健挑战(Partridge et al.,
2018)。几个国家的平均预期寿命已经超过80岁,自1900年以来,美国的平均预期寿命已经从47岁增加到75岁(Dwyer-Lindgren et al.,
2017;(Kontis et al., 2017)。增长最快的年龄组是“最高龄”(>
85岁),这意味着更多的人活到老年。衰老会导致组织和器官功能的退化。与年龄相关的骨质流失最早开始于生命的第三个十年,在骨质达到峰值后立即开始(Weaver et
al.,
2016)。骨质疏松症是由大量骨质流失引起的,是最常见的代谢性骨质疏松症,也是一个主要的公共健康问题,影响着4400万美国人。随着人口老龄化和寿命延长,骨质疏松症正在成为全球性的流行病。据估计,有2亿人患有骨质疏松症。根据国际骨质疏松基金会最近的统计,在世界范围内,每3名女性和每5名50岁以上的男性中就有1人会经历骨质疏松性骨折。2000年,骨质疏松性骨折多达900万例(Gullberg等,1997;Johnell和Kanis,
2006),到2050年,世界范围内的髋部骨折发生率预计将分别在女性和男性中增加240%和310%
(Gullberg等,1997)。尽管在开发预防和治疗骨质疏松症的治疗方法方面做出了重大努力,但人们对衰老导致骨缺损的方式仍不完全了解。因此,抗再吸收治疗被不加区别地用于老年患者,没有一个坚实的理论基础。此外,没有解释间歇性甲状旁腺激素治疗的可变疗效(Jilka
et al.,
2010;Kennel等,2003;李等,2013;万等,2008;王等,2018;Wu等人,2010),唯一可用的合成代谢治疗,从一个病人到另一个。因此,基于我们对骨质疏松症老年患者骨骼衰老机制的新认识,迫切需要新的治疗策略。
近年来对动物的深入研究,使我们对骨衰老的特征和骨细胞在衰老背景下的功能变化有了更详细的认识。成骨细胞对旧骨的吸收和成骨细胞对新骨的形成是成骨细胞在成骨过程中不断重塑的过程(Hill,
1998;Hill等,1997;芒迪的观点,1994)。随着年龄的增长,骨吸收不能通过成骨细胞骨形成得到充分的补偿,导致净骨丢失。在细胞水平上,成骨细胞生成下降、破骨细胞形成和活性增加、骨髓脂肪生成增加是骨骼衰老的关键表型(Devlin
and Rosen, 2015;法尔和科斯拉,2019年;Kim等,2017;Manolagas,
2018)。尤其是,成熟的成骨细胞实际上是非复制细胞,需要不断从骨髓间充质干细胞中补充(Park et al.,
2012)。骨髓间充质干细胞成骨细胞供应不足是导致年龄相关性骨质流失的主要原因之一。越来越多的证据支持msc的年龄相关变化,包括自我更新潜能的丧失、衰老细胞数量的增加、成骨细胞发生的减少或脂肪生成的增加(Bruna
et al., 2016;Ganguly等,2017;Liu等,2015;Sethe et al.,
2006)。此外,骨细胞变化在骨骼衰老过程中的作用最近也得到了研究。骨细胞通过骨小管网状结构(LCN)感知机械信号,衰老与骨细胞数量减少和更小更球形的骨陷窝有关,导致骨对机械载荷的响应紊乱(Dallas
et al.,
2013;吉尔卡和奥布莱恩,2016;Hemmatian等,2017)。衰老过程中骨细胞凋亡和细胞衰老的增加已被注意到。有人提出,骨细胞的这些变化可能导致年龄相关性骨质疏松和骨质丢失(Farr和Almeida,
2018;Sherk and Rosen, 2019)。
Bone Remodeling Unit - an overview | ScienceDirect Topics
https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/bone-remodeling-unit
Osteoblasts/clasts and PTH/calcitonin | Student Doctor Network
https://forums.studentdoctor.net/threads/osteoblasts-clasts-and-pth-calcitonin.951561
Mar 03, 2018 · PTH in its long term affect causes activition of old osteoclasts
in bone and it produces new osteoclasts as well. but in its short term effect it
activates the calcium channel pump on the osteocytes which pumps calciums out of
the bone.
Activation of osteoblasts by PTH involves growth factors, transcription
factors, MAPKs, several regulatory molecules, and cell cycle regulatory
proteins.
PTH and PTHrP Signaling in Osteoblasts
www.ncbi.nlm.nih.gov/pmc/articles/PMC2723940/
Bone Signaling & RANKL - Basic Science - Orthobullets
https://www.orthobullets.com/basic-science/9010/bone-signaling-and-rankl
Osteoclast activation stimulates bone resorption. Molecules that stimulate bone
resorption RANKL RANKL (ligand) is secreted by osteoblasts and binds to the RANK
receptor on osteoclast precursor and mature osteoclast cells. PTH (secreted by
many cancer cells) activation of its receptor stimulates adenylyl cyclase.
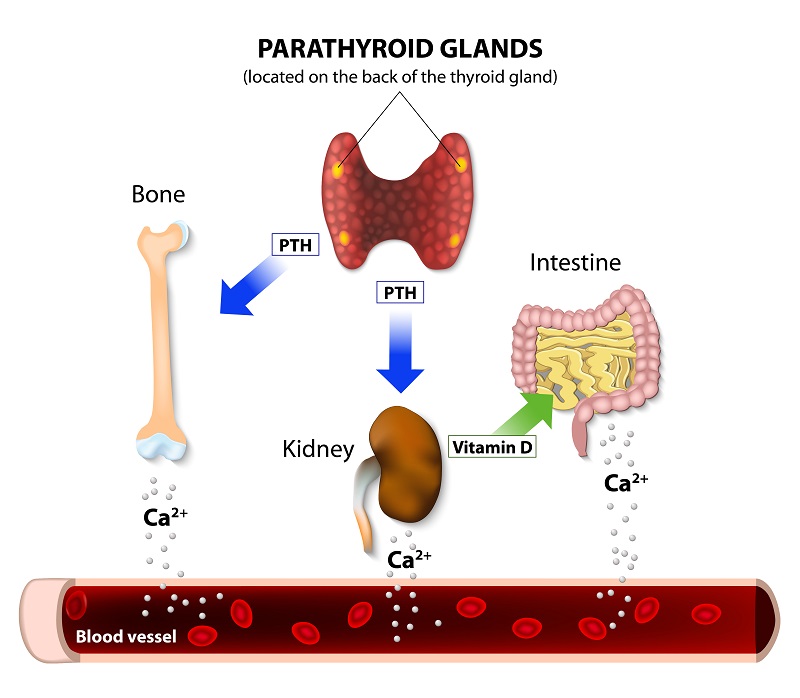
Parathyroid Gland: Calcium Metabolism, Osteoclasts & PTH ...
https://study.com/academy/lesson/parathyroid-gland...
Apr 30, 2013 · Osteoclasts are the cells that break down bone. Parathyroid
hormone can also act on the kidneys to raise blood calcium levels. It does this
by stimulating calcium reabsorption by the kidneys, so more calcium stays in the
body and less is excreted through the urine. The antagonist to parathyroid
hormone is calcitonin.
正常的血钙水平取决于年龄-甲状旁腺
https://www.parathyroid.com/Normal-Blood-Calcium-Levels.htm
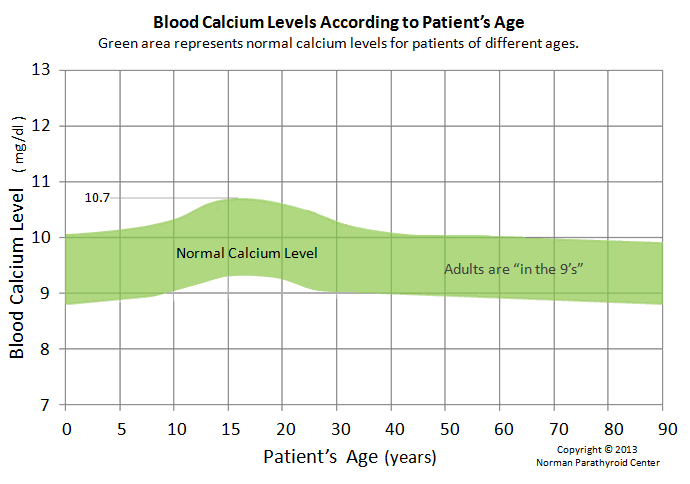
甲状旁腺的作用是维持血钙水平在正常范围内。这个小的正常范围因年龄的不同而不同。图中的绿色区域显示了我们一生中血液钙的正常范围是如何变化的。底部的X轴是我们的年龄(以年为单位),竖直的Y轴是血液中的钙含量。注意,当我们十几岁时,血液中的钙含量会急剧增加,骨骼也会生长(而且会越来越高)。26岁时,我们的骨骼是最强壮的。
The role of the parathyroid glands is to maintain blood calcium levels in a
normal range. This small normal range is different for different ages. The green
area on this graph shows how the normal range for blood calcium changes as we go
through life. The bottom X axis is our age in years, and the vertical Y axis is
the amount of calcium in the blood. Note how the blood calcium increases quite
dramatically when we are teenagers and growing bone (and getting taller). At age
26 our bones are the strongest and mos…
Normal Blood Calcium Levels Depend on Age - parathyroid.com
https://www.parathyroid.com/Normal-Blood-Calcium-Levels.htm
Hypercalcemia: What’s Causing a Too-High Calcium Level in ...
https://health.clevelandclinic.org/hypercalcemia-whats-causing-a-too-high-calcium...
Dec 12, 2018 · Hypercalcemia is a condition that occurs when the calcium levels
in your blood are above the normal range. This can happen for a number of
reasons …
汗液流失的钙降低骨密度
由科学一刻的工作人员
发布于2005年9月22日
汗水是好的。当你太热的时候,汗液在你皮肤上蒸发,可以让你的身体凉快下来。汗液也为你的身体提供了一个很好的废物处理系统,当它让你凉快下来的时候,可以排出毒素和其他废物。然而,对于流汗过多的顶级运动员来说,太多的好东西可能意味着麻烦。
实际上,这些运动员会开始从身体中排出钙等矿物质。由于钙是骨骼的主要成分,这些运动员可能会失去骨密度,并发展出一系列骨骼问题,包括应力性骨折和过早骨质疏松症。
我们说的流汗量是多少?这是一个停止锻炼,多看电视的好借口吗?不是真的。发现这一点的研究人员,孟菲斯大学的Robert
Klesges,对大学篮球运动员进行了研究。在3个小时的高强度训练中,这些运动员惊人地减少了6磅甚至更多的汗水。那大约是三夸脱的汗!
Klesges通过拧出运动员的t恤来收集汗水。他发现他们在每次训练中都流失了大量的钙,平均每个运动员在三个月的训练和比赛中流失了将近4%的骨骼物质。
幸运的是,这种骨质流失可以通过在剧烈运动期间饮用富含钙的运动饮料或过度出汗来弥补。对于我们这些不是顶尖运动员的人来说,这应该足以确保我们获得推荐的每日钙摄入量——大约1000到1300毫克。
“通过对骑车者汗液的分析,研究人员发现,无论在锻炼前还是锻炼后服用补充剂,运动后血液中的钙含量都会下降。然而,事先服用补品可以将这种减少降至最低。科学家认为,这可能会对骨骼对剧烈运动的反应产生更大的影响”
Sweating Out Your Bones: Losing Bone Density | A Moment of Science - Indiana
Public Media
https://indianapublicmedia.org/amomentofscience/sweating-out-your-bones/
The Regulation of Calcium, Magnesium, and Phosphate Excretion by the Kidney |
Abdominal Key
https://abdominalkey.com/the-regulation-of-calcium-magnesium-and-phosphate-excretion-by-the-kidney/
哈佛妇女健康观察
哈佛健康 骨骼外的钙 Calcium beyond the bones - Harvard Health
发表:2010年3月
钙可以在我们的身体中不属于它的地方积累。过多的钙摄入量是罪魁祸首吗?
钙是人体中最丰富的矿物质。几乎所有的——99%——都储存在骨骼中,在那里它可以维持骨骼和牙齿的健康。但这并不是它的全部功能。钙对肌肉、血管和神经的正常功能也是必不可少的。在体内和体外的每一个细胞的液体中都有微量的溶质。过多或过少的钙对这些细胞都是致命的,所以身体会小心控制自己的血液水平。
然而,偶尔,软组织中的钙沉积会导致医疗问题或测试结果不准确。例如,即使你的血钙水平是正常的,钙沉积称为钙化可能积累在组织损伤的部位。患有这些沉积或其他钙累积症(例如肾结石)的女性可能会怀疑自己是否摄入了过多的矿物质——其中包括骨骼健康补充剂。他们有理由担心吗?
一般来说,答案是“不”。研究人员还没有发现钙摄入量(通过食物或补充剂)与软组织积聚之间有任何直接联系。那么钙是如何沉积在骨骼之外的呢?这是我们目前所知道的。
乳房钙化
大约50%的50岁以上妇女和10%的年轻妇女的乳房组织中发现钙化。没有任何症状;只有当乳房x光检查显示出各种形状和大小的白点或斑点时,你才会意识到它们。大多数是良性的,但也有一些与乳腺癌同时发生,因此放射科医生必须确定是否需要活检或进一步的检测。
良性乳腺钙化可作为损伤的一种反应。当乳房的任何部位受到损伤——手术、辐射、创伤、感染或囊肿——脂肪细胞就会死亡,释放出与钙结合形成沉积物的脂肪酸。例如,在事故发生后的安全带沿线(见图)或接受过乳腺癌放疗的区域可能会发生钙化。
乳房因受伤而钙化
乳房x线照片显示乳腺钙化
乳房x光检查显示,一名女性在车祸中因安全带受伤,胸部出现良性钙化。
照片由医学博士Tanya W. Stephens提供安德森癌症中心
钙化也可能发生在产奶的腺体组织(小叶)和将牛奶输送到乳头的导管中。即使你没有怀孕或哺乳,小叶也会分泌少量含钙的液体。如果钙结晶,它可能会出现在乳房x光检查中。小叶钙化有时很普遍,但几乎都是良性的。另一方面,导管钙化偶尔是浸润性导管原位癌(DCIS)的一种征象。
钙化和乳腺癌之间的联系有几个原因。例如,在DCIS中,位于导管中心的癌细胞可能会死亡,因为它们无法获得血液和营养,沿着导管的路径留下一条钙化的线。在癌细胞死亡的区域,癌细胞间受损的结缔组织,以及存在DCIS钙化的区域,钙化也可能与侵袭性癌症有关。
一般来说,微钙化(直径小于1毫米)比大钙化(直径大于2毫米)更可疑,并且紧密聚集的沉积物比分散的沉积物更可疑。如果你的医生认为有任何恶性肿瘤的可能,她或他会建议活检。(绝大多数都是良性的。)其他成像技术对钙化的可视化价值有限。
与钙摄取有关吗? 通过饮食和补充剂摄取钙与良性乳腺钙化无关。此外,2009年一项针对6万多名瑞典女性的研究发现,摄入更多的钙并不会增加患乳腺癌的风险。
牛奶碱综合症:旧病复发
几十年前,溃疡患者被告知要多吃牛奶和奶油,并服用碳酸氢钠(一种碱)来中和酸,保护胃壁。其中一些患者(2% -
18%,视研究而定)出现了一种危及生命的症状,称为乳碱综合征,其特征是高血钙、高pH值、肾功能障碍以及角膜、肺和淋巴结钙化。
当溃疡治疗被放弃时,这种综合症几乎消失了,但它又重新出现了,主要是在服用高剂量碳酸钙补充剂以及含有碳酸钙的Tums等抗酸剂的女性中。在一项研究中,德克萨斯的研究人员检查了1998年至2003年间因高钙水平入院的所有病人的图表。在排除了肾病和甲状旁腺功能亢进的患者后,他们发现牛奶碱综合征是9%的病例的罪魁祸首,而在血液中钙含量极高的病例中,这一比例为26%。这种症状更容易发生在每天摄入超过2000毫克的单质钙的人身上,也就是说,补充剂中钙的含量,而不是补充剂本身的含量,通常是碳酸钙。(500毫克的碳酸钙片通常含有200毫克的单质钙。)将高剂量钙和维生素D结合以增加其吸收的妇女也面临风险。脱水对患有贪食症或慢性晨吐的女性来说是一种风险,它还会破坏血液的酸碱平衡,从而提高钙的水平。阅读补充剂上的标签,确保你每天摄入的钙元素不超过推荐量:1200到1500毫克。
心血管钙化
钙可以在血管壁受伤后形成的动脉斑块中积累。斑块一开始通常很软,但最终趋于硬化和钙化。此外,血管细胞本身有时会转化为成骨细胞,当场产生额外的钙。
冠状动脉。动脉钙化的人更容易患心脏病,但目前还不清楚钙化斑块是否比软斑块更容易破裂并导致心脏病发作。
冠状动脉疾病的风险可以通过冠状动脉中钙的含量来预测,通过CT扫描来测量——甚至在校正了其他心脏病风险因素之后。但是美国心脏协会不推荐这种心脏扫描,如果你能根据你的病史或其他危险因素判断出你患心脏病的风险是低还是高的话。如果你处于中度风险(在未来10年内心脏病发作的几率为10%到20%),冠状动脉钙扫描可能会帮助你的医生确定追求他汀类药物等治疗的积极程度。
如果你出现胸痛,扫描冠状动脉钙可能有助于确定是否是心脏病引起的。超声心动图是一种利用声波产生跳动心脏的动态图像的方法,它可能会揭示主动脉瓣钙化,从而大大增加患冠状动脉疾病的风险。
大脑相关的动脉。在大多数接受脑部CT扫描的病人中,无论出于何种原因,颈动脉(颈部)和椎动脉(脊柱)都显示出钙化的迹象。这些钙化可能是中风的独立危险因素:2007年的一项研究发现,钙化在血栓相关(缺血性)中风患者中尤其常见。
与钙摄取有关吗?证据是有限的,但钙的摄入量似乎不会增加冠状动脉钙化的风险。事实上,高水平的钙通常被认为对心脏健康有益,因为它与较低的血压和体重有关。然而,也有一些令人担忧的发现。一些研究(但不是全部)发现,服用钙剂的女性患心脏病的风险增加了。参与15项针对不同情况的钙补充剂随机试验的研究人员正在收集近1.2万人的不良事件数据,以寻找任何关联。
乳腺血管钙化
乳腺动脉钙化(BACs)是乳房x光检查中常见的表现(见图),不会增加患癌风险。但它们是否预示着其他血管的钙化,从而增加患心脏病的风险?
乳房血管钙化
血管壁上的钙通常呈轨迹状(见红色箭头);它通常与动脉硬化(动脉壁的结构变化,通常由于年龄)有关。
照片由医学博士Tanya W. Stephens提供安德森癌症中心
患有BACs的女性确实有更高的心脏病风险,但是康涅狄格大学的研究表明,BACs的存在并不能预测心脏病的发展。相反,衰老似乎是导致BACs和心脏病的共同原因。
肾结石
肾脏是控制钙平衡的关键。每天,大约有10克钙通过肾脏过滤;其中约1.5%会随尿液排出,其余的会被重新吸收。肾结石是由尿液中的晶体与液体分离而形成的硬块。最常见的是草酸钙。根据哈佛大学的研究,有肾结石倾向的人在尿液中排泄的钙大约比没有肾结石的人多三分之一。他们可能从饮食中吸收了更多的钙,从而排泄出更多的钙,或者他们的身体正在流失钙,这增加了他们患低骨密度和肾结石的风险。
如果你患有肾结石,你的尿液中钙含量很高,医生可能会给你开一种噻嗪类利尿剂,以促进钙在骨骼中的滞留,并减少钙在尿液中的释放。如果你的血液和尿液中都含有高水平的钙,你可能会接受甲状旁腺功能亢进(hyperparathyroidism)的检查。甲状旁腺功能亢进是一种扰乱钙的调节、增加肾结石风险的疾病。
消费联系吗?许多消费者网站,甚至一些医生建议,肾结石患者应该减少钙的摄入量,以防止复发。他们是不正确的。事实上,饮食中的钙似乎可以减少结石的形成。哈佛医学院的研究人员报告说,采用dashstyle饮食法的女性患肾结石的风险要低40%。dashstyle饮食法是一种富含钙的饮食法,以帮助降低血压而闻名。哈佛大学的埃里克·泰勒博士说:“我们对DASH饮食作为治疗肾结石的方法感到非常兴奋。”饮食中的钙具有这种作用,因为它与草酸(存在于菠菜、茶、巧克力和其他植物食品中)结合,并阻止其在肠道中的吸收。这意味着供肾脏处理的草酸更少,患草酸钙肾结石的风险也更低。
关节和肌腱中的钙
关节内的滑膜液含有钙,关节内的软骨也含有钙。当钙结晶时,产生的微小碎片磨损关节表面,刺激酶的释放,进一步分解软骨。在接受骨关节炎置换手术的膝关节中,60%存在含钙晶体。
钙也会在肌腱中积聚,尤其是肩部的肌腱套,从而导致钙化性肌腱炎。这种积累似乎发生在有某种组织损伤或细胞变化的地方,尽管不一定涉及创伤性损伤或过度使用。效果取决于钙化的数量、位置和大小。有时它们根本不会引起任何症状,但它们会发炎,导致相当大的肩膀疼痛和有限的活动范围。钙化性肌腱炎可以通过消炎药、湿热或冰来缓解疼痛,并通过物理疗法来保持活动范围。
与身体其他部位的钙化不同,肌腱沉积物有时会被打破,并通过针或手术(关节镜或开放)移除。
与钙摄取有关吗?除了某些罕见的代谢紊乱导致血钙升高外,关节和肌腱的钙化是一种不受钙摄入量影响的局部过程。
Calcium beyond the bones - Harvard Health
https://www.health.harvard.edu/womens-health/calcium-beyond-the-bones
钙和磷酸盐在与细胞外液体的骨平衡中沉淀和吸收
羟基磷灰石hydropatile不沉淀在细胞外液中,尽管钙和磷酸盐离子过饱和。
钙和磷酸盐在与细胞外液体的骨平衡中沉淀和吸收
羟基磷灰石不沉淀在细胞外液中,尽管钙和磷酸盐离子过饱和。细胞外液中钙离子和磷酸盐离子的浓度远远大于导致羟基磷灰石沉淀所需的浓度。然而,抑制剂几乎存在于身体的所有组织以及血浆中,以防止这种沉淀;其中一种抑制剂是焦磷酸盐(pyrophosphate)。因此,羟基磷灰石晶体不能沉淀在正常组织中,除了在骨骼中,尽管离子过饱和度的状态。
骨钙化的机制。骨形成的初始阶段是成骨细胞分泌胶原分子(称为胶原单体)和基质(主要是蛋白聚糖)。胶原单体快速聚合形成胶原纤维;由此产生的组织变成了类骨质,这是一种软骨样的物质,与软骨不同的是,钙盐很容易沉淀在软骨中。当类骨形成时,一些成骨细胞被包裹在类骨中并静止。在这个阶段,它们被称为骨细胞。
在类骨质形成后的几天内,钙盐开始沉淀在胶原纤维表面。沉淀物首先出现在胶原纤维的空隙处,形成微小的nidi,并在数天或数周内迅速繁殖和生长,形成最终产品羟基磷灰石。
最初沉积的钙盐不是羟基磷灰石晶体,而是无定形化合物(非晶态),是盐的混合物,如CaHPO4·2H2O、Ca3(PO4)2·3H2O等。然后通过取代和添加原子的过程,或重新吸收和再沉淀,这些盐在数周或数月的时间内转化为羟基磷灰石晶体。少数的百分比可能永远处于无定形状态。这一点很重要,因为当细胞外液中需要额外的钙时,这些无定形盐可以被迅速吸收。
钙盐在类骨质中沉积的机制尚不完全清楚。有一种理论认为,在形成的时候,胶原蛋白纤维是预先为引起钙盐沉淀而特别形成的。成骨细胞还可能分泌一种物质到类骨质中,以中和一种通常阻止羟基磷灰石结晶的抑制剂(据信是焦磷酸盐)。一旦焦磷酸盐被中和,胶原纤维对钙盐的天然亲和力就会导致沉淀。
异常情况下钙在非骨组织中的沉淀。虽然钙盐在骨外的正常组织中几乎不沉淀,但在异常情况下,钙盐会沉淀。例如,在动脉硬化的情况下,它们沉淀在动脉壁上,导致动脉变成骨样管。同样,钙盐经常沉积在退化的组织或旧血凝块中。据推测,在这些情况下,通常阻止钙盐沉积的抑制剂因子从组织中消失,从而允许沉淀。
Precipitation and Absorption of Calcium and Phosphate in Bone-Equilibrium
with the Extracellular Fluids
https://www.brainkart.com/article/Precipitation-and-Absorption-of-Calcium-and-Phosphate-in-Bone-Equilibrium-with-the-Extracellular-Fluids_20031/
焦磷酸盐是一种有效的钙化抑制剂;它拮抗无机磷酸盐与钙结晶形成羟基磷灰石的能力,可能是通过占据初生生长的羟基磷灰石晶体表面的一些无机磷酸盐位点;这些不规则现象会减缓或终止晶体的生长。229三种分子(ENPP1、ANK和TNAP)被确定为焦磷酸盐水平的中心调控因子(图32.9)。
焦磷酸盐-概述|科学的直接主题
www.sciencedirect.com/topics/neuroscience/pyrophosphate
Pyrophosphate acts as a potent inhibitor of calcification; it antagonizes the
ability of inorganic phosphate to crystallize with calcium to form
hydroxyapatite, presumably by occupying some of the inorganic phosphate sites on
the surface of nascent growing hydroxyapatite crystals; the irregularities
created slow down or terminate crystal growth. 229 Three molecules (ENPP1, ANK,
and TNAP) have been identified as central regulators of pyrophosphate levels
(Fig. 32.9).
Pyrophosphate - an overview | ScienceDirect Topics
www.sciencedirect.com/topics/neuroscience/pyrophosphate
在胶原蛋白和明胶、琼脂凝胶双重扩散条件下沉淀磷酸钙
采用一维双扩散法测定了37℃下重组结缔组织胶原蛋白和琼脂凝胶以及25℃下明胶凝胶中磷酸盐钙沉淀的临界浓度。实验在无缓冲的0.15 mol dm - 3
NaCl存在下进行,或将0.15 mol dm - 3 NaCl-veronal调整到pH
7.4。结果表明,沉淀组分CaCl2和磷酸缓冲液(ph7.4)的临界沉淀浓度均为等摩尔,且与初始浓度比值无关。临界沉淀浓度不受所用凝胶的浓度和种类的影响。通过x射线衍射分析,首次形成的析出物呈非晶态结构。析出物的红外光谱(IR)表明,CaHPO4·H2O是它们的优势种。化学分析得到的摩尔钙磷比为1.08。沉淀物及时转化为磷酸八钙( octacalcium
phosphate)。在所有实验中,沉淀开始时,在实际沉淀盘的两侧同时在凝胶柱中形成两层非常薄的沉淀膜。红外光谱和化学分析表明,这两种膜与实际的沉淀盘是一致的。
关键字
磷酸钙沉淀双扩散胶原蛋白
Precipitation of calcium phosphates under conditions of double diffusion in
collagen and gels of gelatin and agar | SpringerLink
https://link.springer.com/article/10.1007/BF02441181
磷氧阴离子
阴离子P
2 o4−
7是PPi的缩写,代表无机焦磷酸盐。它是由ATP在细胞中水解成AMP而形成的。
ATP→AMP + PPi
例如,当一个核苷酸被聚合酶整合到正在生长的DNA或RNA链中时,焦磷酸盐(PPi)就会释放出来。焦磷酸解与聚合反应相反,聚合反应中焦磷酸与3’-核苷磷酸酯(NMP或dNMP)反应,从寡核苷酸中分离出相应的三磷酸(DNA中的dNTP或RNA中的NTP)。
焦磷酸盐阴离子具有P
2 o4−
是磷酸酐。在水溶液中不稳定,水解成无机磷酸盐:
P
2 o4−
7 + H2O→2 HPO2−
4
或者用生物学家的简写:
PPi + H2O→2 + 2 H+
在没有酶催化的情况下,简单的聚磷酸盐如焦磷酸盐、线性三磷酸盐、ADP和ATP的水解反应通常在除高酸性介质外的所有介质中进行得极其缓慢
(与此相反的反应是通过加热磷酸盐制备焦磷酸盐的方法。)
水解成无机磷酸盐有效地使ATP裂解为AMP和PPi不可逆,与此水解反应耦合的生化反应也不可逆。
PPi发生在滑膜液、血浆和尿液中,其水平足以阻止钙化,可能是细胞外液(ECF)中羟基磷灰石形成的天然抑制剂。[5]细胞可将胞内PPi导入ECF。[6]
ANK是非酶质膜PPi通道,支持细胞外PPi水平。细胞膜PPi通道ANK功能缺陷与细胞外PPi低、细胞内PPi升高有关。胞外核肽焦磷酸酶/磷酸二酯酶(ENPP)可提高细胞外PPi
从高能磷酸盐核算的角度来看,ATP水解成AMP和PPi需要两个高能磷酸盐,而将AMP还原成ATP需要两个磷酸化反应。
AMP + ATP→2 ADP
2 ADP + 2→2 ATP
焦磷酸无机的血浆浓度的参考范围0.58 - -3.78µM预测区间(95%)。[7]
ATP→AMP + PPi
phosphorus oxyanion The anion P
2O4−7 is abbreviated PPi, standing for inorganic pyrophosphate. It is formed by
the hydrolysis of ATP into AMP in cells.
ATP → AMP + PPi
Pyrophosphate - Wikipedia
https://en.wikipedia.org/wiki/Pyrophosphate
线粒体功能障碍导致钙化
细胞外焦磷酸盐代谢缺陷促进哈钦森-吉尔福德早衰综合征小鼠模型血管钙化,该模型在焦磷酸盐治疗后得到改善
背景:
早衰素(progerin)是Aamin
A的一种突变形式,导致Hutchinson-Gilford早衰综合征(HGPS)。HGPS是一种过早衰老的疾病,其特征是过度动脉粥样硬化和血管钙化,导致早逝,主要是心肌梗死或中风。本研究的目的是探讨HGPS血管过度钙化的机制。
方法和结果:
我们在表达progerin的野生型小鼠和敲入型LmnaG609G/+小鼠中进行表达和功能研究,模拟HGPS的主要临床表现。LmnaG609G/+小鼠主动脉钙化过度,这些早衰动物的主动脉原代血管平滑肌细胞抑制血管钙化的能力受损。这种表达早衰素的血管平滑肌细胞缺陷与组织非特异性碱性磷酸酶的表达和活性增加以及线粒体功能障碍有关,后者导致ATP合成减少。因此,LmnaG609G/+血管平滑肌细胞在产生和细胞外积累焦磷酸盐方面存在缺陷,焦磷酸盐是血管钙化的主要抑制剂。我们还发现LmnaG609G/+小鼠血浆中碱性磷酸酶活性增加,ATP和焦磷酸盐水平降低,而磷和钙没有发生变化。焦磷酸盐对早衰小鼠血管钙化有抑制作用。
高磷血症引起血管钙化,从而强调Pi稳态在CPD中的重要性。Hyperphosphatemia causes vascular calcification, thus underscoring the importance of Pi homeostasis in CPD.
结论:
LmnaG609G小鼠的过度血管钙化是由细胞外焦磷酸盐积累减少引起的,焦磷酸盐的积累是由血管平滑肌细胞线粒体功能障碍导致的组织非特异性碱性磷酸酶活性增加和ATP可用性降低造成的。焦磷酸盐处理可改善过度钙化。这些发现揭示了HGPS中先前未明确的致病过程,这一过程也可能导致正常衰老过程中的血管钙化,因为progerin在没有HGPS的个体的血管组织中逐渐积累。
Defective Extracellular Pyrophosphate Metabolism Promotes Vascular
Calcification in a Mouse Model of Hutchinson-Gilford Progeria Syndrome That Is
Ameliorated on Pyrophosphate Treatment | Circulation
https://www.ahajournals.org/doi/full/10.1161/CIRCULATIONAHA.112.000571
Alkaline Phosphatase High Symptoms, Causes, Treatment
https://www.healthcheckup.com/general/alkaline...
Jun 26, 2018 · Vitamin D deficiency is one of the main causes of elevated
alkaline phosphatase. Enough exposure to the sun can help increase the levels of
vitamin D in the body. Enough exposure to the sun can help increase the levels
of vitamin D in the body.
Alkaline Phosphatase High Symptoms, Causes, Treatment
https://www.healthcheckup.com/general/alkaline...
Jun 26, 2018 · Vitamin D deficiency is one of the main causes of elevated
alkaline phosphatase. Enough exposure to the sun can help increase the levels of
vitamin D in the body. Enough exposure to the sun can help increase the levels
of vitamin D in the body.
Alkaline phosphatase - Wikipedia https://en.wikipedia.org/wiki/Alkaline_phosphatase Alkaline phosphatase or basic phosphatase is a homodimeric protein enzyme of 86 kilodaltons. Each monomer contains five cysteine residues, two zinc atoms, and one magnesium atom crucial to its catalytic function, and it is optimally active at alkaline pH environments. ALP has the physiological role of dephosphorylating compounds. The enzyme is found across a multitude of organisms, prokaryotes …
Alkaline Phosphatase - an overview | ScienceDirect Topics https://www.sciencedirect.com/topics/neuroscience/alkaline-phosphatase Alkaline phosphatase activity is important for the mineralization of bone and represents a useful biochemical marker of bone formation [76,77]. Osteoblasts express the bone- or tissue-non-specific isoform of alkaline phosphatase (TNAP), which is a glycosylphosphatidylinositol (GPI) anchored cell surface protein [78] .
焦磷酸盐:组织矿化的关键抑制剂
突出了
•
焦磷酸盐可以防止不必要的钙化,使其成为人体天然的“水软化剂”。
•
细胞中ATP的分解是细胞外焦磷酸盐的重要来源。
•
细胞外焦磷酸盐增加导致骨骼矿化受损。
•
降低焦磷酸盐水平可导致许多临床疾病,例如血管钙化。
•
这些药物,双磷酸盐,是焦磷酸盐的化学稳定类似物。
无机焦磷酸盐长期以来被认为是许多细胞内生物合成反应的副产品,并在20世纪60年代首次被确定为一种关键的内源性生物矿化抑制剂。焦磷酸盐的主要来源似乎是细胞外ATP,它以可控的方式从细胞中释放出来。ATP一旦释放,可被外核苷焦磷酸酶/磷酸二酯酶快速水解产生焦磷酸盐。焦磷酸盐的主要作用是直接抑制羟基磷灰石的形成,从而起到生理“软水剂”的作用。有证据表明焦磷酸盐也可能作为一种信号分子,影响基因表达,调节自身的生产和分解。这篇综述将总结我们目前对焦磷酸盐代谢的理解,以及它如何调节骨矿化和防止有害软组织钙化。
Pyrophosphate: a key inhibitor of mineralisation - ScienceDirect
https://www.sciencedirect.com/science/article/pii/S1471489216300339
Magnesium as a Calcification Inhibitor - Advances in ...
https://www.ackdjournal.org/article/S1548-5595(17)30214-8/fulltext
In the CKD population, a decrease in levels of active inhibitors and a
simultaneous increase in levels of active inducers of calcification
(including hyperphosphatemia, hypercalcemia, inflammatory cytokines, oxidative
stress, uremic toxins, and advanced glycation end products) are responsible for
the extremely high prevalence of intimal and medial
VC and valvular calcification.
Evidence for Pyrophosphate to be the Primary Inhibitor of ...
https://www.fightaging.org/archives/2018/12/evidence-for-pyrophosphate-to-be-the...
Because tissue mineralization may occur at normal concentrations of calcium and
phosphate, regulatory mechanisms exist to limit this process to bone and
cartilage. Several endogenous inhibitors of vascular calcification have been
identified, including the matrix Gla protein, fetuin A, osteopontin, and
焦磷酸盐是血管钙化的主要抑制剂的证据
有证据表明,基于提高血管壁焦磷酸盐水平的治疗可以减少与年龄相关的钙化。血管壁通过钙沉积、钙化而矿化,是导致血管硬度随年龄增长的机制之一。它会损害血管收缩和放松的能力。这是一个严重的问题,因为它破坏了控制血压的反馈机制,导致高血压、血管疾病和心力衰竭,因为心肌生长和减弱。
在我看来,这里的研究是一个很好的例子,说明了解决老龄化问题的错误方法。研究人员指出,随着年龄的增长,这一过程会发生偏差,因此他们分析了这一过程的功能失调和正常运作,以找到调节这一过程的蛋白质。然后,治疗包括找到安全调节这些蛋白质水平的方法,在老年个体中克服它们的状态,试图迫使这一过程产生更好的结果。正如过去半个世纪所证明的那样,通过这种战略可以以巨大的代价和高失败率产生边际的、递增的收益。最令人印象深刻的结果涉及到通过改变我们的生物学来降低血液胆固醇、血压和炎症的方法。
但只有通过这种方式才能取得渐进的结果。这是一种完全忽视问题根源的策略。老化是由细胞和组织损伤的形式造成的,然后通过一个漫长、复杂和不为人知的后果链螺旋式上升。例如,衰老细胞——以及它们所产生的慢性全身炎症——似乎会使血管壁中的细胞偏向于钙的沉积。但是衰老的细胞会引发一系列其他的问题。试图在狭窄的钙化情况下覆盖细胞行为,而不能去除衰老的细胞,让这些错误的细胞自由地造成所有其他老化问题。你不能强迫一台损坏的机器像完好无损一样工作。这种衰老的方法没有未来。研究团体必须关注损伤的原因和修复,而不是继续这种昂贵的、边缘的、最终徒劳无功的尝试,试图推翻细胞行为,一次衰老的一小部分。
血管钙化与生理衰老有关,其特征是主动脉介质和/或内膜中钙磷酸盐晶体的沉积,通常为骨的主要成分羟基磷灰石。血管钙化降低主动脉和动脉的顺应性和弹性,阻碍心血管系统功能。它与不良的临床结果有关,并有助于心血管发病率和死亡率。由于组织矿化可能发生在正常浓度的钙和磷酸盐下,因此存在调控机制,将这一过程限制在骨骼和软骨中。已经鉴定出几种血管钙化的内源性抑制剂,包括基质Gla蛋白、胎蛋白A、骨桥蛋白和焦磷酸盐。
焦磷酸盐是钙磷酸盐晶体形成和生长的有效抑制剂。血管组织矿化发生在合成血管钙化抑制剂受损或钙磷酸盐晶体的形成增强时,例如高磷血症,这是血管钙化的主要危险因素。尽管研究结果表明高磷血症可引起血管钙化,但高磷血症对细胞外焦磷酸盐代谢的影响尚不清楚。最近的一项研究探讨了磷酸盐诱导血管钙化背景下焦磷酸盐的代谢。结果表明,焦磷酸盐是一种被动的钙化过程,可以积极预防。
这项新研究的主要结论是,随着时间的推移,高磷酸盐浓度导致焦磷酸盐的合成增加。此外,焦磷酸盐的水解在高磷血症的早期呈下降趋势,但在后期呈上升趋势。虽然高磷血症时焦磷酸盐的总体产量较高,但不足以阻止钙磷沉积。越来越多的证据表明焦磷酸盐是血管钙化的主要内源性抑制剂。本研究的结果,以及之前的研究结果表明,诱导焦磷酸盐合成可能是一种简单而有效的治疗策略,以抑制与衰老和其他病理条件有关的血管钙化。
Evidence for Pyrophosphate to be the Primary Inhibitor of Vascular
Calcification – Fight Aging!
https://www.fightaging.org/archives/2018/12/evidence-for-pyrophosphate-to-be-the-primary-inhibitor-of-vascular-calcification
高磷酸血症Hyperphosphatemia
高磷血症通常是慢性肾病的并发症。降低风险的一个方法是减缓肾脏损伤。通过治疗引起肾脏疾病的原因来保护肾脏。
高磷血症:症状、治疗和原因
www.healthline.com/health/hyperphosphatemia
高磷血症-维基百科
高磷酸盐血症是一种电解质紊乱,其中血液中的磷酸盐水平升高。大多数人没有症状,而其他人在软组织中形成钙沉积。通常也有低钙水平,可以导致肌肉痉挛。病因包括肾衰竭、假性甲状旁腺功能减退、甲状旁腺功能减退、糖尿病酮症酸中毒、肿瘤溶解综合征和横纹肌溶解。诊断通常基于血中磷酸盐水平高于1.46
mmol/L。
Hyperphosphatemia - Wikipedia
Hyperphosphatemia is an electrolyte disorder in which there is an elevated level
of phosphate in the blood. Most people have no symptoms while others develop
calcium deposits in the soft tissue. Often there is also low calcium levels
which can result in muscle spasms. Causes include kidney failure,
pseudohypoparathyroidism, hypoparathyroidism, diabetic ketoacidosis, tumor lysis
syndrome, and rhabdomyolysis. Diagnosis is generally based on a blood phosphate
levels of greater than 1.46 mmol/L…
1706/5000
血管钙化:诱导剂和抑制剂
与传统观点不同的是,越来越多的证据表明,包括血管钙化在内的异位矿物沉积大多是活跃的过程,很多时候类似于骨矿化过程。药物的数量参与平滑肌细胞(SMCs)的某些亚群向成骨细胞样实体的分化,以及细胞外基质骨化过程的激活和启动。另一方面,也有一些因素阻止这种分化和异位磷酸钙的形成。在正常的生理环境中,钙原调节因子和钙反调节因子的活性是协调的,可以防止异常钙化的发生。然而,在某些病理生理条件下,如动脉粥样硬化、慢性肾病(CKD)和糖尿病,这种平衡被改变,导致异常的异位矿物质沉积。了解调控异位矿物形成和抑制的因素将有助于制定预防和/或治疗此类软组织钙化的组织工程策略。目前的综述集中在似乎与临床相关的因素和/或可能有助于发展未来的组织再生策略。还讨论了这些因素的临床应用和意义。
突出了
•血管钙化过程的类型。•血管钙化的诱导物。•血管钙化的抑制剂。•血管钙化治疗的临床应用。•对开发新的组织工程策略的启示。
Vascular calcification: Inducers and inhibitors - ScienceDirect
https://www.sciencedirect.com/science/article/pii/S092151071100287X
饮食磷酸盐和被遗忘的肾脏病人:FDA监管行动的关键需要
建议谨慎的饮食管理,减少高磷酸盐的摄入,以减缓慢性肾病(CKD)的进展,预防CKD的并发症,并可能有助于降低慢性疾病的风险,如在健康的普通人群中与高磷酸盐摄入相关的CKD事件。对于接受维持性透析治疗的患者,控制血清磷水平被认为是良好护理的一个标志,需要一个协调的计划,限制饮食中的磷酸盐摄入量,使用口服磷酸盐粘合剂,并提供一个适当的透析处方。即使采用传统的每周三次血液透析或腹膜透析,使用磷酸盐结合剂,并共同努力限制饮食中磷酸盐的摄入量,也不可能在所有透析患者中充分控制血清磷水平。限制磷酸盐摄入的努力受到了加工食品和一些药物中磷酸盐含量被低估和未量化的阻碍,因为在加工或药物配方过程中添加了磷酸盐添加剂或辅料。通过美国食品和药物管理局(fda)的简单监管行动,有可能有效限制磷酸盐摄入。在所有包装食品和药物上强制标注磷酸盐含量,将有助于识别健康的低磷酸盐食品和药物,并允许对磷酸盐的总摄入量进行至关重要的控制。监管政策和标签的简单改变是有必要的,这将有助于在肾病的所有阶段更好地管理饮食中磷酸盐的摄入量,并可能降低普通人群的健康风险。
Dietary Phosphate and the Forgotten Kidney Patient: A Critical Need for FDA
Regulatory Action - American Journal of Kidney Diseases
https://www.ajkd.org/article/S0272-6386(18)31119-3/fulltext
1006/5000
磷是什么?
磷是一种存在于骨骼中的矿物质。除了钙,磷还需要建立强壮健康的骨骼,以及保持身体其他部位的健康。
为什么磷对你很重要?
正常工作的肾脏可以清除血液中多余的磷。当你患有慢性肾病(CKD),你的肾脏不能很好地去除磷。高磷水平会对你的身体造成伤害。多余的磷会导致身体发生变化,把钙从骨骼中拉出来,使骨骼变得虚弱。高磷和高钙水平也会导致危险的钙沉积在血管、肺、眼睛和心脏。随着时间的推移,这会导致心脏病发作、中风或死亡的风险增加。磷和钙的控制对你的整体健康非常重要。
血液中磷的安全水平是多少?
正常的磷含量为2.5至4.5 mg/dL。询问你的肾脏医生或营养师你最近的磷水平是多少,并把它写下来,以帮助跟踪它。
Phosphorus and Your CKD Diet | National Kidney Foundation
https://www.kidney.org/atoz/content/phosphorus

导演席上:磷“无声杀手”
保罗·凯勒曼,医学博士
"正常功能的肾脏可以清除血液中的磷。然而,在CKD患者中,肾脏不能去除磷这种物质,这可能导致钙从骨骼中流失,并沉积在器官上。"
虽然我们不是你的立场,但我们知道在透析的饮食限制下生活是多么困难。你无法排出食物中所含的磷,这些磷是含有蛋白质的食物,如乳制品和肉类。我们希望你吃大量的蛋白质,但要限制磷的摄入量。
为什么我不能吃含磷高的食物?
因为你的肾脏不排泄磷,当你吃东西的时候吸收到你身体里的磷是不会排泄的。透析会去除一些磷,但不会像肾脏那样去除那么多。因此,你血液中的磷含量会上升,对你的身体产生多种不良影响。
人体正常的磷含量是多少?
如果你的肾脏工作正常,你的肾脏会排出磷,并保持你的血液水平在2.5-4.5毫克/分升。
磷水平的目标是什么?
在透析病人中,我们希望你的磷水平保持在5.5毫克/分升以下。
如果我的磷含量高于5.5毫克/分升会对我的身体产生什么影响?
当磷水平上升时,它与血液中的钙结合。这种组合会带来两件坏事。首先,当钙和磷结合时,磷酸钙,也就是白垩,会跑到你的血液系统之外,硬化所有与之接触的组织,比如你的心脏、皮肤和肌肉。其次,当钙与磷一起离开血液系统时,血液中钙含量的降低会导致一种叫做PTH的激素的释放,这种激素会把钙从骨骼中取出来,使钙在血液中保持正常。另外,如果你的磷真的很高,我们不能给你提供你在透析中获得的维生素D
(Zemplar),你需要它来降低PTH并保护你的骨骼。
那么高磷对我的身体意味着什么呢?
你全身的动脉硬化,你可能会得很严重的皮肤溃疡,你的骨头会变软。
那么为什么把磷称为杀手呢?
因为动脉硬化,无论是对心脏还是对身体其他部位,都是透析患者的头号杀手,甚至对那些还没有透析但患有肾病的患者也是如此。如果你控制磷,动脉硬化就会减缓或停止。
如何将血液中的磷保持在5。5毫克/分升以下?
首先,营养师建议你吃低磷食物。其次,你需要服用“粘合剂”,这是一种药丸,它能在你的胃吸收食物中的磷进入你的系统之前,将食物中的磷结合起来。这就是为什么当你开始吃东西的时候,而不是吃完之后,你应该带上你的活页夹。
如果你有关于控制磷的问题,请咨询你的营养师、护士或医生。
Phosphorus – The 'Silent Killer'
https://www.wisconsindialysis.org/kidney-health/healthy-eating-on-dialysis/phosphorus--the-silent-killer/
植物蛋白对慢性肾脏疾病的影响。
https://healthcare.utah.edu/healthfeed/postings/2016/01/ckd_plants.php
另一种解释与体内磷的含量有关。正常功能的肾脏可以清除血液中的磷。然而,在CKD患者中,磷不能去除矿物质,这可能导致钙从骨骼中流失,并沉积在器官上。
The Impacts of Plant Protein on Chronic Kidney Disease ...
https://healthcare.utah.edu/healthfeed/postings/2016/01/ckd_plants.php
Another explanation deals with the levels of phosphorus in the body. Normal
functioning kidneys remove phosphorous in the blood. However, in patients with
CKD the phosphorous cannot remove the mineral and that can lead to leaching of
calcium from the bones, and deposits of calcium on organs.
Phosphate—a poison for humans? - Kidney International
https://www.kidney-international.org/article/S0085-2538(16)30137-5/fulltext
Phosphate—a poison for humans?
Maintenance of phosphate balance is essential for life, and mammals have
developed a sophisticated system to regulate phosphate homeostasis over the
course of evolution. However, due to the dependence of phosphate elimination on
the kidney, humans with decreased kidney function are likely to be in a positive
phosphate balance. Phosphate excess has been well recognized as a critical
factor in the pathogenesis of mineral and bone disorders associated with chronic
kidney disease, but recent investigations have also uncovered toxic effects of
phosphate on the cardiovascular system and the aging process. Compelling
evidence also suggests that increased fibroblastic growth factor 23 and
parathyroid hormone levels in response to a positive phosphate balance
contribute to adverse clinical outcomes. These insights support the current
practice of managing serum phosphate in patients with advanced chronic kidney
disease, although definitive evidence of these effects is lacking. Given the
potential toxicity of excess phosphate, the general population may also be
viewed as a target for phosphate management. However, the widespread
implementation of dietary phosphate intervention in the general population may
not be warranted due to the limited impact of increased phosphate intake on
mineral metabolism and clinical outcomes. Nonetheless, the increasing incidence
of kidney disease or injury in our aging society emphasizes the potential
importance of this issue. Further work is needed to more completely characterize
phosphate toxicity and to establish the optimal therapeutic strategy for
managing phosphate in patients with chronic kidney disease and in the general
population.
Phosphate—a poison for humans? - Kidney International
https://www.kidney-international.org/article/S0085-2538(16)30137-5/fulltext
Magnesium in CKD: more than a calcification inhibitor?
Abstract
Magnesium fulfils important roles in multiple physiological processes.
Accordingly, a tight regulation of magnesium homeostasis is essential.
Dysregulated magnesium serum levels, in particular hypomagnesaemia, are common
in patients with chronic kidney disease (CKD) and have been associated with poor
clinical outcomes. In cell culture studies as well as in clinical situations
magnesium levels were associated with vascular calcification, cardiovascular
disease and altered bone-mineral metabolism. Magnesium has also been linked to
diseases such as metabolic syndrome, diabetes, hypertension, fatigue and
depression, all of which are common in CKD. The present review summarizes and
discusses the latest clinical data on the impact of magnesium and possible
effects of higher levels on the health status of patients with CKD, including an
outlook on the use of magnesium-based phosphate-binding agents in this context.
Keywords
Magnesium Chronic kidney disease Cardiovascular disease Diabetes Depression
Magnesium in CKD: more than a calcification inhibitor? | SpringerLink
https://link.springer.com/article/10.1007%2Fs40620-014-0140-6
Gla-Rich Protein Acts as a Calcification Inhibitor in the
Human Cardiovascular System
Objective—
Vascular and valvular calcifications are pathological processes regulated by
resident cells, and depending on a complex interplay between calcification
promoters and inhibitors, resembling skeletal metabolism. Here, we study the
role of the vitamin K–dependent Gla-rich protein (GRP) in vascular and valvular
calcification processes.
Approach and Results—
Immunohistochemistry and quantitative polymerase chain reaction showed that GRP
expression and accumulation are upregulated with calcification simultaneously
with osteocalcin and matrix Gla protein (MGP). Using conformation-specific
antibodies, both γ-carboxylated GRP and undercarboxylated GRP species were found
accumulated at the sites of mineral deposits, whereas undercarboxylated GRP was
predominant in calcified aortic valve disease valvular interstitial cells.
Mineral-bound GRP, MGP, and fetuin-A were identified by mass spectrometry. Using
an ex vivo model of vascular calcification, γ-carboxylated GRP but not
undercarboxylated GRP was shown to inhibit calcification and osteochondrogenic
differentiation through α-smooth muscle actin upregulation and osteopontin
downregulation. Immunoprecipitation assays showed that GRP is part of an
MGP–fetuin-A complex at the sites of valvular calcification. Moreover,
extracellular vesicles released from normal vascular smooth muscle cells are
loaded with GRP, MGP, and fetuin-A, whereas under calcifying conditions,
released extracellular vesicles show increased calcium loading and GRP and MGP
depletion.
Conclusions—
GRP is an inhibitor of vascular and valvular calcification involved in calcium
homeostasis. Its function might be associated with prevention of calcium-induced
signaling pathways and direct mineral binding to inhibit crystal
formation/maturation. Our data show that GRP is a new player in mineralization
competence of extracellular vesicles possibly associated with the fetuin-A–MGP
calcification inhibitory system. GRP activity was found to be dependent on its
γ-carboxylation status, with potential clinical relevance.
Gla-Rich Protein Acts as a Calcification Inhibitor in the Human Cardiovascular
System | Arteriosclerosis, Thrombosis, and Vascular Biology
https://www.ahajournals.org/doi/10.1161/ATVBAHA.114.304823
维生素K:氧化还原调节,预防线粒体功能障碍和抗癌作用
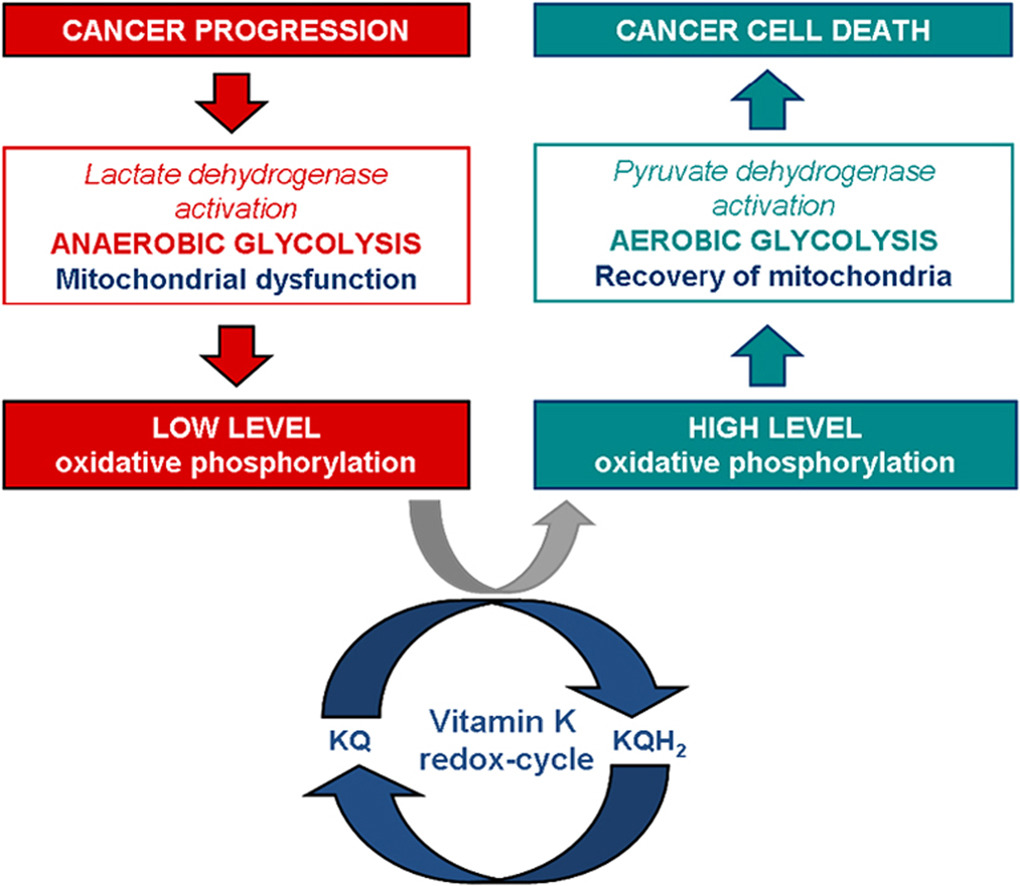
本文针对redox-modulating属性和抗癌作用的维生素K的概念主要集中在两个方面:(i)维生素K
redox-cycle及其影响钙稳态,“致癌”和“onco-suppressive”活性氧和特定的诱导氧化应激在癌症;(ii)维生素K +
C作为一个强大的氧化还原系统,在线粒体复合物ii和III之间形成旁路,从而防止线粒体功能障碍,恢复氧化磷酸化和需氧糖酵解,调节内源性氧化还原对的氧化还原状态,消除癌细胞缺氧环境,诱导细胞死亡。分析数据表明,维生素c和维生素k可以使癌细胞对常规化疗敏感,从而降低药物的有效剂量,并将有害副作用降到最低。这篇综述面向广大读者——从学生到该领域的专家。

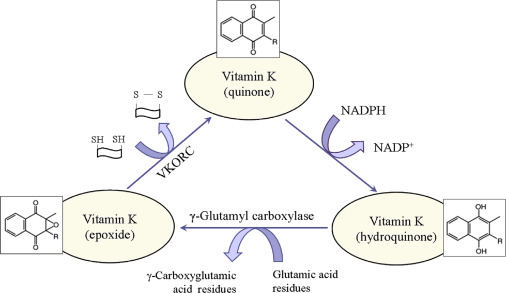
Fig. 2. Metabolic redox-cycle of vitamin K. VKORC – vitamin K-dependent epoxide reductase complex.
Vitamin K: Redox-modulation, prevention of mitochondrial dysfunction and
anticancer effect - ScienceDirect
https://www.sciencedirect.com/science/article/pii/S2213231718300934
Koncentrated K, all natural vitamin with three types of ...
https://www.k-vitamins.com/index.php?page=Why_K
* Vitamin K2, or menaquinones, have been found to improve mitochondria
functioning in cells. Mitochondria are unique structures in the cells of people.
They serve as batteries, generating energy and powering the cell and the body.
Vitamin K2 Is a Mitochondrial Electron Carrier That ...
https://science.sciencemag.org/content/336/6086/1306
UBIAD1 was localized in mitochondria and was able to convert vitamin K1 into
vitamin K2/menaquinone (MK- n, n the number of prenylgroups). In bacteria,
vitamin K2/MK- n acts as an electron carrier in the membrane and, similarly, in
Drosophila , mitochondrial vitamin K2 appeared to act as an electron carrier to
facilitate adenosine triphosphate production.
维生素K2是一种线粒体电子载体。
https://science.sciencemag.org/content/336/6086/1306
UBIAD1定位于线粒体,能够将维生素K1转化为维生素K2/menaquinone (MK- n,
n为prenylgroups的数目)。在细菌中,维生素K2/MK-
n作为细胞膜上的电子载体,同样,在果蝇中,线粒体维生素K2似乎作为电子载体促进三磷酸腺苷的生成。
Nucleation and inhibition of hydroxyapatite formation by ...
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1217486
Jul 01, 1996 · Abstract. Many proteins found in mineralized tissues have been
proposed to function as regulators of the mineralization process, either as
nucleators or inhibitors of hydroxyapatite (HA) formation. We have studied the
HA-nucleating and HA-inhibiting properties of proteins from bone [osteocalcin
(OC), osteopontin (OPN),...
羟基磷灰石的成核与抑制作用。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1217486
1996年7月1日许多在矿化组织中发现的蛋白质被认为是矿化过程的调节因子,或者是羟基磷灰石(HA)形成的核因子或者抑制剂。我们研究了骨[骨钙素(OC),骨桥蛋白(OPN),…
羟基磷灰石钙沉积病
Calcium Hydroxyapatite Deposition Disease
羟基磷灰石沉积病是一种存在磷酸钙晶体沉积的疾病,主要沉积于关节周围的软组织,尤其是肌腱。
钙化性肌腱炎是指发生于肩胛上肌腱的钙化性肌腱炎。然而,钙化性关节炎一词表示病情较好,因为沉积物也可能在肌腱以外的组织中发现。
其他用于这种情况的名称有:内窥镜炎煅烧区、羟基磷灰石风湿病等。
羟磷灰石钙是最丰富的钙在人类骨骼和羟磷灰石的沉积和其他基本磷酸钙晶体发生作为主要或特发性实体和次级过程在许多条件下像一个终末期肾病,胶原血管疾病,维生素D中毒,tumoral钙质沉着。营养不良钙化也主要是羟基磷灰石钙。
羟基磷灰石沉积病是一种类似痛风和焦磷酸钙脱水沉积病的晶体沉积病,这些晶体沉积病之间存在着相当大的重叠。
羟基磷灰石沉积病引起的钙化性肌腱炎
羟基磷灰石沉积症引起的钙化性肌腱炎,图片维基百科GNU许可
羟基磷灰石钙沉积病的发病机制
其发病机制尚不清楚。创伤、异常压力、压迫、局部血管减少、局部缺氧和先前存在的组织变性被认为是可能的诱发因素。
目前已经确定了这种情况的三个阶段。这里描述的是肩关节。
沉默的阶段
这是钙沉积完全包含在肌腱内的初始阶段,肌腱表面有明显的界限。患者在这个阶段没有任何症状。
机械相
机械相的特征是沉积物的增大,可能产生撞击样的症状。沉积物液化导致压力增加和滑囊炎。沉积物仍在肌腱内。
复发性滑囊炎可导致滑囊下或囊内沉积物破裂。这个阶段的特点是急性疼痛发作。
胶粘剂周炎
这是一个晚期阶段,以全身虚弱、疼痛、活动受限为特征。不同大小的钙沉积在肌腱套内,显示出相当大的破坏性变化。
羟基磷灰石钙沉积病的表现
羟基磷灰石沉积症或钙化性关节炎最常影响中年人。
男性略多于女性。这些沉积物的患者可能没有症状,也可能出现反复出现的疼痛和不同程度的残疾症状。急性发作也是众所周知的。
虽然肩区至今仍是羟基磷灰石钙沉积的常见部位,但这些沉积部位在其他部位也有发生。
关节周围沉积已发现几乎所有关节,以及在一些肌腱插入远离关节。肩关节最常见,其次是髋关节、肘关节、手腕和膝盖。
肌腱羟基磷灰石沉积松散地发生在靠近关节附近的肌腱插入部位,但也有远处沉积。例如臀大肌插入,大收肌插入,胸大肌插入。
实验室研究
实验室检测结果通常正常。
单个羟基磷灰石钙分子体积小,在偏振光下除了作为聚集体出现有光泽但非双制冷剂外,在光学显微镜下不可见。
透射电镜下的电子衍射研究可用于明确鉴定羟基磷灰石钙晶体,但方法有限。
成像
在x射线下,羟基磷灰石钙沉积是均匀的无定形密度和缺乏小梁,这使得它们不同于异质骨化或副骨。大小可以是可变的。它们的形状大致是卵形、线形或三角形,边缘光滑而模糊。
CT或MRI可用于鉴别病变与其他情况。软骨钙质沉着症可能被注意到
偶尔,钙化性周围关节炎可能产生骨糜烂下立即插入所涉及的肌腱。侵蚀的原因尚不清楚。
关节内羟基磷灰石沉积病[密尔沃基肩]
这也被称为磷灰石相关的破坏性关节炎。这是一种破坏性的肩关节病变,与慢性肩袖撕裂和含有羟基磷灰石晶体激活胶原酶、中性蛋白酶的关节积液有关。
最常见的受影响的患者是老年妇女,通常涉及主导肩膀。
虽然原因并不十分清楚,但有人认为是关节内的晶体沉积导致了胶原酶、丝氨酸蛋白酶、弹性酶和白细胞介素-1等释放酶的产生。这导致关节功能下降和关节解剖退化。
受累的肩膀通常肿胀,可能无痛或疼痛。关节抽吸可产生大量滑膜液,常伴有血。该液体含有羟基磷灰石晶体的聚集体,激活胶原酶,中性蛋白酶,颗粒胶原蛋白。
有时,在流体中也经常发现焦磷酸钙二水合物晶体,支持密尔沃基肩综合征可能是一种混合疾病的理论。
x线显示关节破坏、肱骨盂关节破坏、狭窄和硬化伴骨化囊肿形成。肱骨头向上半脱位由于肩袖断裂可能是明显的。
膝关节受累在密尔沃基肩综合征患者中很常见[50%],此处的影像学表现与焦磷酸钙关节病非常相似,很难区分。两者也可能作为一种混合晶体沉积病共存。
羟基磷灰石沉积症的鉴别诊断
其他的晶体沉积,如假性结晶沉积[焦磷酸钙二水合物沉积病]和痛风,在表现和影像学上可能类似于羟基磷灰石沉积病,并可能有关节周围沉积。
转移性钙化可发生在关节周围的一些疾病的终末期肾病和肾骨性营养不良,甲状旁腺功能亢进,维生素D过多和肿瘤钙质沉着。
潜在的疾病或大尺寸的钙化应允许区别于羟磷灰石钙沉积疾病
胶原血管疾病如硬皮病和皮肌炎可表现为软组织钙化。
继发于创伤的异质骨化可能发生在关节周围。小梁可能不同于羟基磷灰石钙沉积病
肿瘤和滑膜骨软骨瘤样病变可能与关节周围软组织肿块内的钙化有关。显著软组织肿块的存在和可能的关节侵蚀可能有助于区分这些实体。
滑膜肉瘤发生在关节周围,有三分之一的病例伴有钙化。骨侵蚀可能存在。
羟基磷灰石沉积症的治疗
羟基磷灰石沉积症的治疗是无特异性的。
急性滑膜炎发作可能是自限性的,可在几天至几周内消退。
抽吸积液和使用任何一种非甾体抗炎药是规定的治疗方法。
口服秋水仙素2周或关节内注射类固醇可缩短症状持续时间和强度。
Calcium Hydroxyapatite Deposition Disease | Bone and Spine
https://boneandspine.com/calcium-hydroxyapatite-deposition-disease/
Role of Osteopontin in Modulation of Hydroxyapatite Formation
https://link.springer.com/article/10.1007/s00223-013-9698-6
Jan 19, 2013 · Role of Osteopontin in Modulation of Hydroxyapatite Formation.
The role of OPN in bone mineralization, if any, is less clear. However, it is
possible that it modulates HA formation, either by preventing crystal growth in
“inappropriate” areas such as the osteoid seam or by regulating crystal growth
habit (size and shape).
骨桥蛋白在调节羟基磷灰石形成中的作用
https://link.springer.com/article/10.1007/s00223-013-9698-6
·骨桥蛋白在调节羟基磷灰石形成中的作用。OPN在骨矿化中的作用,如果有的话,是不太清楚的。然而,它也有可能调节HA的形成,或者通过阻止晶体在“不适当”的区域(如骨样缝)生长,或者通过调节晶体生长习惯(大小和形状)。
1985年1月;37(1):57-62。
骨钙素对体外脂质诱导羟基磷灰石形成及种子羟基磷灰石生长的影响。
Boskey AL, Wians FH Jr, Hauschka PV。
摘要
骨钙素是一种含骨-羧酸-谷氨酸的蛋白质,是合成并定位于骨组织中的主要非胶原蛋白之一。此前,研究人员基于该蛋白的体内外特性提出,它可能参与控制矿化起始和/或羟基磷灰石(HA)的生长。本研究比较了骨钙素对脂质诱导的HA形成和HA种子生长的体外影响。虽然骨钙素抑制HA的生长,但从骨钙素浓度依赖的一级速率常数下降可以看出,kCa、骨钙素对脂质诱导的钙化无影响,kCa在.033
h-1处保持不变。结合研究表明,骨钙素与检测到的脂质大分子(磷脂酰丝氨酸、磷脂酰肌醇、由磷脂制备的钙酸性磷脂-磷酸酯(Ca-PL-PO4)复合物不相关,但与HA结合的亲和力较高。这些数据表明,a)骨钙素与含有凝血蛋白的γ羧谷氨酸有很大的不同,后者对酸性磷脂和HA都有很高的亲和力,b)骨钙素对HA的初始ca
- pl - po4依赖性形成几乎没有影响。
Calcif Tissue Int. 1985 Jan;37(1):57-62.
The effect of osteocalcin on in vitro lipid-induced hydroxyapatite formation and
seeded hydroxyapatite growth.
Boskey AL, Wians FH Jr, Hauschka PV.
Abstract
Osteocalcin, the bone gamma-carboxy glutamic acid containing protein, is one of
the major noncollagenous proteins both synthesized and localized in bony tissue.
Previously, investigators have suggested, based on the in vitro and in vivo
properties of this protein, that it may be involved in controlling initiation of
mineralization and/or hydroxyapatite (HA) growth. In this study, the in vitro
effects of osteocalcin on lipid-induced HA formation, and HA seeded growth were
compared. Although osteocalcin inhibited the growth of HA, as indicated by the
osteocalcin concentration-dependent decreases in the first order rate constant,
kCa, osteocalcin had no effect on lipid-induced calcification, kCa remaining
constant at .033 h-1. Binding studies revealed that osteocalcin did not
associate with the lipid macromolecules tested (phosphatidyl serine,
phosphatidyl inositol, and the Ca-acidic phospholipid-phosphate (Ca-PL-PO4)
complexes prepared from these phospholipids) although the protein bound to HA
with high affinity. These data suggest that a) osteocalcin is quite distinct
from the gamma carboxy glutamic acid containing clotting proteins which have a
high affinity for both the acidic phospholipids and for HA, and b) that
osteocalcin has little effect on the initial Ca-PL-PO4-dependent formation of
HA.
The effect of osteocalcin on in vitro lipid-induced hydroxyapatite formation
and seeded hydroxyapatite growth. - PubMed - NCBI
https://www.ncbi.nlm.nih.gov/pubmed/3922598
Plasma levels of pyrophosphate, an endogenous inhibitor of vascular
calcification, are reduced in end-stage renal disease and correlate inversely
with arterial calcification. However, it is not known whether the low plasma
levels are directly pathogenic or are merely a marker of reduced tissue levels.
Vascular calcification is dependent on plasma levels of ...
www.ncbi.nlm.nih.gov/pmc/articles/PMC4308968/
正常水平的细胞外焦磷酸盐足以预防血管钙化
血管钙化依赖于血浆焦磷酸盐水平
important role for circulating extracellular pyrophosphate
in preventing
vascular calcification
血浆焦磷酸盐水平是血管钙化的内源性抑制剂,在终末期肾脏疾病中降低,与动脉钙化呈负相关。然而,目前还不清楚低血浆水平是直接致病还是仅仅是组织水平降低的标志。这在一个动物模型中进行了测试,在正常小鼠和缺乏外核肽焦磷酸酶磷酸二酯酶(释放细胞外焦磷酸酶)的Enpp1−/−小鼠之间移植主动脉。Enpp1−/−小鼠血浆焦磷酸盐水平极低,2个月时发生主动脉钙化,高磷酸盐饮食可大大加速主动脉钙化。Enpp1
- /
-小鼠主动脉移植到高磷酸盐饲料喂养的野生型小鼠后没有进一步钙化。野生型小鼠的主动脉移植在Enpp1−/−小鼠中钙化,但钙化程度小于相邻受体Enpp1−/−主动脉。野生型和Enpp1−/−小鼠移植时,供体和受体主动脉钙含量没有差异,这表明移植本身并不影响钙化。组织学显示内侧钙化,无排斥迹象。因此,正常水平的细胞外焦磷酸盐足以预防血管钙化,而全身Enpp1缺乏足以产生血管钙化,尽管正常的血管外焦磷酸盐生产。这为细胞外循环焦磷酸盐预防血管钙化奠定了重要的基础。
讨论
缺乏NPP1的小鼠自发地发展为主动脉钙化,在其模式中仅处于中间位置。这不能用全身钙或磷酸盐水平的差异来解释,尽管如前所述,高磷酸盐饮食大大增加了钙化。TNAP或成骨转录因子osterix的表达也没有增加,这可以解释更大的钙化。然而,在Enpp1−/−小鼠中几乎检测不到血浆ePPi,这与ePPi缺乏症是钙化的原因一致,表明NPP1几乎负责所有循环的ePPi。这与培养细胞的情况相反,在培养细胞中,NPP1和假定的转运体ANK对ePPi
11的贡献似乎相等。循环ePPi的组织来源仍有待确定。目前的数据表明,骨骼是ePPi的主要来源,而血管系统不太可能起作用,因为孤立的主动脉不释放ePPi的净量。
Enpp1 - /
-主动脉的钙化在移植到Enpp1+/+胎鼠后完全被抑制,这表明正常小鼠体内的ePPi水平足以防止进一步的血管钙化。虽然不能排除与ePPi不同的另一个循环因素,但这是不太可能的,因为NPP1缺乏症的动脉钙化可以通过消除TNAP11在小鼠中预防,通过使用双磷酸盐(PPi的类似物)治疗在人类中减少。有趣的是,钙含量没有减少,这表明钙化不是自发可逆的。
移植到Enpp1 - /
-小鼠体内的野生型主动脉钙化也证明了全身PPi的重要性。虽然远低于邻近的Enpp1−/−主动脉或移植到Enpp1−/−小鼠体内的Enpp1−/−主动脉,但这种差异的部分原因可能是移植时Enpp1−/−主动脉存在钙化,可以作为进一步钙化的nidus。因此,尽管存在正常的血管NPP1活性,但循环ePPi的几乎缺失可导致血管钙化。
组织ePPi的其他潜在决定因素包括膜转运蛋白ANK和外成酶组织非特异性碱性磷酸酶(TNAP)。Enpp1−/−小鼠的极低血浆PPi表明,ANK对循环水平没有显著影响,但它可能对血管壁内的ePPi有影响,因为缺乏ANK的小鼠在高磷酸盐饮食下会发生动脉钙化11。ANK的这种局部效应得到了研究结果的支持,即从这些小鼠主动脉中培养出来的主动脉钙化程度增加。但目前尚不清楚ANK是通过促进PPi
10的转运直接控制ePPi水平,还是通过转运NPP1提供ATP
14间接控制ePPi水平。TNAP水解ePPi,其在骨中的强劲表达使ePPi在循环水平时发生矿化,可完全抑制羟基磷灰石的形成15;16。尿毒症17例血管平滑肌TNAP活性增高,加重全身ePPi缺乏。
NPP1的其他作用可能影响血管钙化独立于ePPi。嘌呤能代谢和信号转导依赖于NPP1
18,因为它是细胞外腺苷合成的第一步,是去除ATP的重要途径。考虑到骨中嘌呤能信号的重要性和血管平滑肌中受体的丰富,嘌呤能信号的扰动也可以解释或促进在没有NPP1时发生的血管钙化。最近的研究表明,缺乏CD73(腺苷生成的最后一种外周酶)会导致人类动脉的广泛钙化。然而,嘌呤能信号在本质上是自分泌或旁分泌的,任何由于NPP1缺乏引起的改变都不应该通过移植到正常小鼠体内来纠正。虽然旁分泌信号有可能延伸至同种异体骨,但不太可能覆盖整个同种异体骨,也没有观察到钙化梯度。这表明嘌呤能信号在血管钙化中不是很重要,或者NPP1缺乏并没有实质性的改变。此外,NPP1与胰岛素受体相互作用,抑制胰岛素信号传导,但同样,这种缺陷不应该通过移植修复或产生。因此,研究结果强烈暗示NPP1仅通过ePPi的产生影响血管钙化。
研究结果为ePPi在血管钙化中的中心作用提供了进一步的证据,并证实了循环ePPi的重要作用。因此,血浆ePPi可能是血管钙化的一个可测量的危险因素,这与我们之前在血液透析患者2中发现的低血浆PPi,以及在肾病患者3中发现的血浆PPi与血管钙化呈负相关是一致的。在动物模型4;21中,外源性PPi抑制血管钙化的能力表明,尽管血浆PPi的半衰期较短,直接给药受到限制,但它也可能是一个可改变的危险因素。在这方面,组织来源的识别将是有用的,其他直接旨在增加血管壁内ePPi的方法,如tnap7抑制剂;22。
Vascular calcification is dependent on plasma levels of pyrophosphate
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4308968/
血浆中无机焦磷酸盐存在于正常人和低磷酸盐血症、成骨不全症等骨功能障碍患者
摘要
建立了一种32
p标记焦磷酸盐同位素稀释法测定人血浆中无机焦磷酸盐(PP1)的方法。通过离子交换色谱洗脱模式、纸层析、无机焦磷酸酶孵育等方法对该方法的特异性进行了评价,结果表明该方法的特异性优于90%。血浆PP1单次估计的99%置信限为±13%。男性和女性血浆PP1无差异,但年轻人(0-15岁)的PP1值略高于老年人。的平均浓度(±SE)
PP1等离子体的73名男性和女性为3.50±0.11μmoles /升(0.217±0.007μg P /毫升)和正常范围(99%限制)1.19
-5.65μmoles /升(0.074 - -0.350μg P /毫升)。
有人认为PP1可能在钙代谢中起重要作用,因为PP1可以在体内和体外阻止磷酸钙的沉淀,并可以减缓羟基磷灰石晶体生长和溶解的速度。因此,在几种骨骼疾病中测定了血浆PP1。成骨不全、骨质疏松、“急性”骨质疏松、原发性甲状旁腺功能亢进均为正常值。低磷血症患者血浆PP1水平升高。血浆中PP1的过量可能是低磷血症矿化不良的原因,骨中碱性磷酸酶的功能可能是钙沉积部位的焦磷酸酶。
Inorganic pyrophosphate in plasma in normal persons and in patients with
hypophosphatasia, osteogenesis imperfecta, and other disorders of bone
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC292015/
ENPP1 -外核肽焦磷酸酶/磷酸二酯酶…
https://www.uniprot.org/uniprot/P22413
核苷焦磷酸酶产生二磷酸(PPi),通过调节焦磷酸酶水平(通过相似性)在骨矿化和软组织钙化中发挥作用。PPi通过结合新生的羟基磷灰石晶体抑制骨矿化和软组织钙化,从而阻止这些晶体的进一步生长(PubMed:11004006)。
ENPP1 - Ectonucleotide pyrophosphatase/phosphodiesterase ...
https://www.uniprot.org/uniprot/P22413
Nucleotide pyrophosphatase that generates diphosphate (PPi) and functions in
bone mineralization and soft tissue calcification by regulating pyrophosphate
levels (By similarity). PPi inhibits bone mineralization and soft tissue
calcification by binding to nascent hydroxyapatite crystals, thereby preventing
further growth of these crystals (PubMed:11004006).
show that hydrolysis of PPi is an intrinsic and critical step of the DNA synthesis reaction catalyzed by dPols. The hydrolysis of PPi occurs after the formation of the phosphodiester bond and ensures that the DNA synthesis reaction is energetically favorable without the need for additional enzymes. Also, we observe that DNA synthesis is a two Mg2+ ion assisted stepwise associative SN2 reaction. Overall, this study provides deep temporal insight regarding the primary enzymatic reaction responsible for genome duplication.
焦磷酸盐水解是DNA合成反应的重要步骤
DNA聚合酶(dPols)的DNA合成是所有生物体基因组复制和维持的核心。dPols通过释放焦磷酸盐(PPi)基团,催化进入的脱氧核苷三磷酸与末端引物核苷酸之间形成磷酸二酯键。认为磷酸二酯键的形成是一种endergonic反应,为了保证DNA合成反应的自由能变化为负,并且可以正向进行,PPi必须通过伴随的焦磷酸酶水解。在没有焦磷酸酶的情况下,DNA合成在体外进行,这一事实代表了一个关于DNA合成反应热力学的长期难题。利用时间分辨结晶学研究表明,PPi的水解是dPols催化的DNA合成反应的一个内在和关键步骤。PPi的水解发生在磷酸二酯键形成后,确保DNA合成反应在不需要额外酶的情况下是积极有利的。此外,我们还观察到,DNA合成是一个二Mg2+离子辅助逐步结合的SN2反应。总的来说,这项研究为基因组复制的主要酶反应提供了深刻的时间洞察力。
Pyrophosphate hydrolysis is an intrinsic and critical step of the DNA
synthesis reaction | Nucleic Acids Research | Oxford Academic
https://academic.oup.com/nar/article/46/12/5875/5017762
血清碱性磷酸酶(ALP)对慢性肾脏疾病的预后具有重要意义
水平的升高意味着ESRD和死亡率的风险更高
作者:Jonathan Taliercio, DO和Sankar Navaneethan, MD, MPH
血清碱性磷酸酶(ALP)升高可促进血管钙化的发生和发展。在普通人群和血液透析患者人群中进行的研究表明,ALP与心血管事件、住院和死亡风险增加之间存在独立关系。在选择性非透析依赖的慢性肾病(CKD)人群中(即ALP水平越高,全因死亡率的风险就越大。
ALP与死亡率之间的关系,以及ALP与终末期肾病(ESRD)进展之间的关系,在较大的异质性人群中尚不清楚。因此,我们在我们的卫生保健系统中跟踪调查了大量不同的非透析依赖CKD人群中这些关系。
病人识别
使用克利夫兰诊所基于电子医疗记录的CKD注册表,我们使用慢性肾病流行病学协作(CKD-
epi)方程确定了28,678名门诊ALP水平介于第一和第二验证性肾小球滤过率(eGFR)值< 60 mL/min /1.73
m2之间的患者。采用分类变量卡方检验和连续变量t检验或Wilcoxon秩和检验比较ALP升高和不升高的CKD患者的基线特征。采用Kaplan-Meier图和logrank检验分析生存率和ESRD。将门诊测得ALP值的慢性肾病患者分为四分位数:<
66个单位/升(U/L);66至81 U/L;82到101 U/L,≥102 U/L。
研究人群平均年龄为72岁(±12)岁;54%是女性,12%是非裔美国人。平均随访2.2年后,588例患者发生ESRD,
4755例患者在到达ESRD前死亡。共有191例患者发生ESRD并于术后死亡。Kaplan-Meier和竞争性风险分析显示,不同ALP水平患者的总死亡率和ESRD有显著差异(p
< 0.001;图1). ALP水平与死亡之间的关系,ALP水平与ESRD之间的关系作为连续变量进行检验时是相似的(图)。
Taliercio-Graph
数字Kaplan-Meier和竞争性风险分析显示,随着血清碱性磷酸酶水平的升高,终末期肾病和死亡的可能性增加。
在多元校正分析中,ALP水平每增加一个标准差(SD) (42.7 U/L),死亡危险增加16%,ESRD危险增加15%。当分析仅限于ALP水平在正常范围内(<
149 U/L)的人群时,观察到类似的结果。
病人来说,血清磷的亚组分析数据(n = 5667),当调整血清磷水平,增加每个SD高山水平与死亡率风险增加10%(95%可信区间[CI]: 1.06 -
-1.14)和一个无意义的ESRD的风险增加9%(95%置信区间:0.99—-1.19)。亚组分析的患者至少有一个尿蛋白测量(n =
14116),调整后对所有+蛋白尿,反是;每增加SD高山水平与死亡率风险增加16%(95%置信区间:1.12—-1.19)和ESRD的危险增加17%(95%置信区间:1.07—-1.26)。
拟议的肾脏损害机制
以往,ALP水平仅被认为是CKD和ESRD患者骨代谢的替代指标。碱性磷酸酶来源于多种组织,但主要集中在肝脏、胆管、骨和胎盘中。组织非特异性ALP使焦磷酸盐失活,焦磷酸盐是一种内源性羟基磷灰石形成抑制剂,羟基磷灰石可导致动脉内血管钙化。在高血压、衰老、糖尿病和CKD等条件下,血管细胞发生成骨分化,表达多种骨相关蛋白,包括ALP。随后,这种分化导致内皮矿化、动脉硬化和血管钙化,从而导致CKD的心血管疾病和死亡率。
我们观察到较高的ALP水平与ESRD之间存在独立的关联。除了血管钙化外,由中心压力测量的动脉硬度也可能导致CKD的进展。动脉硬化对肾脏损害的机制包括(a)高脉动血压和流向低阻力肾血管床,(b)滤过屏障缺陷导致黄疸性高血压、超滤和最终的肾硬化。
结论
总之,ALP水平升高与ESRD风险增加和非透析依赖CKD患者的全因死亡率有关。这些发现,连同以前的研究,表明临床医生可能使用ALP作为风险评估工具,以确定有较高死亡率和/或进展到ESRD风险的患者。
Serum Alkaline Phosphatase Has Prognostic Importance in Chronic Kidney
Disease – Consult QD
https://consultqd.clevelandclinic.org/serum-alkaline-phosphatase-has-prognostic-importance-in-chronic-kidney-disease/
焦磷酸钙沉积(CPPD)
祖母和祖父
快速的事实
CPPD的风险随着年龄的增长而大大增加,但也可能发生在年轻人身上。
正确的诊断取决于在受影响关节的液体中检测焦磷酸钙晶体。
CPPD可能很难诊断,因为关节疼痛和其他症状可以模拟痛风和其他类型的关节炎。
用显微镜观察关节液中细小的焦磷酸钙晶体,证实诊断。
消炎药可以减轻疼痛和肿胀,可以预防或帮助缓解CPPD的症状,但没有办法摆脱晶体。
由一种叫做焦磷酸盐的钙盐晶体引起的关节问题可能是最容易被误解的关节炎形式之一。这些晶体的关节问题经常被误认为是痛风和其他疾病。正确的诊断很重要。未经处理的焦磷酸钙沉积(CPPD)可能导致严重、痛苦的发作或慢性(长期)疼痛和炎症。随着时间的推移,关节可能退化或断裂,导致长期残疾。一些治疗关节炎疼痛的方法确实存在,但这些方法不能治疗潜在的晶体沉积。一些潜在的原因是可以治疗的,应该在患有CPPD的人群中进行评估(见下面的原因)。
CPPD是什么?
CPPD是一种关节炎,正如假性关节炎的旧名所示,它可以引起类似痛风的症状。然而,在焦磷酸钙中,另一种叫做焦磷酸钙的晶体引发了这种反应。CPPD会导致一个或多个关节剧烈疼痛和肿胀,这可能会限制几天或几周的活动。它还能引起更持久的关节炎,类似于骨关节炎或类风湿关节炎。这种情况最常发生在膝盖,但也会影响手腕、肩膀、脚踝、肘部、手或其他关节。
晶体沉积在软骨(缓冲关节内部的组织)中,会损伤软骨。这些晶体还会引起炎症,导致关节疼痛、发热和肿胀。
在大多数情况下,晶体形成的原因尚不清楚,尽管晶体沉积明显随年龄增长而增加。因为这种病有时是家族遗传的,基因可能起了一定作用。专家们不知道如何预防这些晶体。如果CPPD是由于其他一些医疗问题,治疗这种情况有时可能防止CPPD恶化。
其他可能导致CPPD的因素包括:
过量铁储存(医学术语:血色素沉着症)
血液中镁含量低(低镁血症)
甲状旁腺过活跃(甲状旁腺功能亢进)
血液中钙过量的一些原因(高钙血症)
甲状腺功能严重减退(甲状腺功能减退)
谁CPPD ?
焦磷酸钙晶体沉积影响约3%的60多岁人群和多达50%的90多岁人群。焦磷酸钙晶体释放到关节液中会吸引白细胞,导致疼痛发作。急性(短期)关节炎的发作可以发生在关节损伤后,手术后,或没有明确的原因。
焦磷酸钙晶体通常存在于没有症状的老年人的软骨甚至滑膜液中。许多有这种晶体沉积的人永远不会有急性痛风样发作或慢性关节炎。这些晶体通常也存在于骨关节炎患者或其他类型的关节炎,如痛风或关节感染。
CPPD是如何诊断的?
诊断取决于症状和医学检测结果。关节的成像,包括超声、x线、CT或MRI,可能有助于发现软骨中存在的含钙沉积物。你的医生必须排除其他潜在的症状原因。这些包括痛风,类风湿关节炎和关节感染。你的医生可能会用针从肿胀或疼痛的关节中取出液体,以查明是否有其他原因或焦磷酸钙晶体存在。你的医生也可能做血液检查。
如何治疗CPPD ?
没有办法溶解这些晶体沉积物。对于急性发作的患者,医生可能会开非甾体类抗炎药,这通常被称为非甾体抗炎药。非甾体抗炎药,如吲哚美辛(Indocin)和萘普生(Naprosyn),治疗严重发作时的疼痛和肿胀。
肾功能差、有胃溃疡病史和/或服用血液稀释剂的人通常不能服用非甾体抗炎药。对于这些患者,让医生排出关节液并在受影响的关节内注射皮质类固醇可能会有帮助。为了防止进一步的攻击,低剂量秋水仙碱(一种更常用于痛风的药物)或非甾体抗炎药可能被证明是有效的。
其他药物可能会帮助一些患有焦磷酸钙晶体关节炎的患者,或患有这些晶体可能引起的较不常见的慢性炎症的患者。这些药物包括羟基氯喹(Plaquenil)、甲氨蝶呤(类风湿关节炎、Trexall、Otrexup、Rasuvo)或一种“白细胞介素1
-拮抗剂”,可以减少炎症,如生物药物anakinra (Kineret)。Anakinra是政府批准的治疗类风湿性关节炎。
在严重的情况下,手术修复和替换受损的关节是一个选择。
Calcium Pyrophosphate Deposition (CPPD)
https://www.rheumatology.org/I-Am-A/Patient-Caregiver/Diseases-Conditions/Calcium-Pyrophosphate-Deposition-CPPD
焦磷酸盐在脱细胞骨水泥形成中的中心作用
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3366957
背景。无机焦磷酸盐(PP i)是一种羟基磷灰石矿物沉淀的生理抑制剂,参与调节矿化组织的发育和病理钙化。局部水平的PP i受降低PP
i和促进矿化的因子(组织非特异性碱性磷酸酶,Alpl/TNAP)的拮抗作用控制,而那些增加局部水平的则受抑制。
引用:73
出版年:2012
作者:Brian L. Foster, Kanako J. Nagatomo, Francisco H
在体外形成焦磷酸钙晶体。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1000520
焦磷酸钙二水合物(CaPPD)晶体在体内如何形成并导致软骨钙质沉着或假性囊肿(焦磷酸钙关节病或焦磷酸钙晶体沉积病)的研究甚少。本研究设计了一种简单的方法来确定晶体在体外沉积的必要条件。
焦磷酸钙晶体的体外形成:焦磷酸钙晶体沉积病(假性脱落)的意义
焦磷酸钙二水合物(CaPPD)晶体在体内如何形成并导致软骨钙质沉着或假性囊肿(焦磷酸钙关节病或焦磷酸钙晶体沉积病)的研究甚少。本研究设计了一种简单的方法来确定晶体在体外沉积的必要条件。在模拟的pH和离子强度生理条件下,在1·5
mmol/l Ca和无机焦磷酸盐(PPi)浓度增加的情况下,45Ca监测晶体形成。启动晶体形成所需的PPi浓度约为40 mmol/l, pH为7·4时为0·5
mmol/l Mg2+时为175
mmol/l。pH值越高,对PPi的要求越低。CaPPD的自然单斜型和三斜型是在体外培养较长时间后产生的,但最初的沉积是无定形的或正交的。讨论了这些观察的生理意义。由于在体外形成晶体所需的PPi浓度远远高于在焦磷酸盐关节病患者滑膜液中自然形成的PPi浓度,这表明晶体更有可能最初沉积在软骨中,而成核机制在体内可能很重要。由于其他工作人员已经观察到,在实验室条件下,其他焦磷酸钙晶体形式缓慢地相互转化为单斜晶型和三斜晶型,所以只有这两种形式在临床条件下出现的原因可能反映了晶体在体内形成的时间较长。
Formation of calcium pyrophosphate crystals in vitro ...
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1000520
Little is known about how calcium pyrophosphate dihydrate (CaPPD) crystals form
in vivo and give rise to chondrocalcinosis or pseudogout (pyrophosphate
arthropathy or calcium pyrophosphate crystal deposition disease). In this study
a simple method has been devised to define the conditions necessary for the
deposition of crystals in vitro.
Role of the Progressive Ankylosis Gene (ank) in Cartilage
Mineralization
Mineralization of growth plate cartilage is a critical event during endochondral
bone formation, which allows replacement of cartilage by bone. Ankylosis protein
(Ank), which transports intracellular inorganic pyrophosphate (PPi) to the
extracellular milieu, is expressed by hypertrophic and, especially highly, by
terminally differentiated mineralizing growth plate chondrocytes. Blocking Ank
transport activity or ank expression in terminally differentiated mineralizing
growth plate chondrocytes led to increases of intra- and extracellular PPi
concentrations, decreases of alkaline phosphatase (APase) expression and
activity, and inhibition of mineralization, whereas treatment of these cells
with the APase inhibitor levamisole led to an increase of extracellular PPi
concentration and inhibition of mineralization. Ank-overexpressing hypertrophic
nonmineralizing growth plate chondrocytes showed decreased intra- and
extracellular PPi levels; increased mineralization-related gene expression of
APase, type I collagen, and osteocalcin; increased APase activity; and
mineralization. Treatment of Ank-expressing growth plate chondrocytes with a
phosphate transport blocker (phosphonoformic acid [PFA]) inhibited uptake of
inorganic phosphate (Pi) and gene expression of the type III Na+/Pi
cotransporters Pit-1 and Pit-2. Furthermore, PFA or levamisole treatment of
Ank-overexpressing hypertrophic chondrocytes inhibited APase expression and
activity and subsequent mineralization. In conclusion, increased Ank activity
results in elevated intracellular PPi transport to the extracellular milieu,
initial hydrolysis of PPi to Pi, Pi-mediated upregulation of APase gene
expression and activity, further hydrolysis and removal of the mineralization
inhibitor PPi, and subsequent mineralization.
n conclusion, our study demonstrates that upregulated expression and
activities of Ank during growth plate chondrocyte hypertrophy and terminal
differentiation, and possibly in articular osteoarthritic cartilage, play a
crucial regulatory element in BCP mineralization in these tissues. Upregulated
Ank expression and activity result in elevated levels of extracellular PPi. The
initial APase activity present in growth plate chondrocytes and osteoarthritic
chondrocytes then hydrolyzes PPi, thereby removing an inhibitor of
mineralization and providing Pi required for further upregulation of APase and
other mineralization-related gene expression. Therefore, the coordinated
regulation of expression and activities of Ank and other proteins involved in
PPi and Pi generation and the control of a precise extracellular PPi level are
absolutely crucial for normal skeletal development and mineralization.
Role of the Progressive Ankylosis Gene (ank) in Cartilage Mineralization
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC538760/
缺氧诱导因子-1在磷酸盐诱导的血管平滑肌细胞钙化中起重要作用
摘要
内侧血管钙化是慢性肾脏疾病(CKD)的常见并发症。虽然升高的无机磷酸盐刺激血管平滑肌细胞(VSMC)成骨分化和钙化,但其在CKD期间钙化的机制尚未完全明确。由于低氧基因激活与CKD相关,并刺激骨细胞成骨分化,我们在体内和体外的啮齿类动物模型中定义了低氧信号在升高的无机磷酸盐诱导的VSMC钙化中的作用。细胞矿化研究表明,无机磷酸盐的升高可迅速诱导VSMC钙化。缺氧增强了无机磷酸盐诱导的VSMC钙化和成骨转分化,可见成骨标志物的表达。缺氧诱导因子-1
(HIF-1)是VSMC钙化增强的关键转录因子。以低氧状态下小鼠VSMC中HIF-1的表达为靶点,通过提高无机磷酸盐来阻断钙化,而HIF-1激活剂,包括临床使用的FG-4592/Roxadustat,则重新创造了一个钙原化环境。升高的无机磷酸盐迅速激活HIF-1,即使在正常的氧合条件下;由HIF-1α亚基的稳定产生影响。因此,缺氧与升高的无机磷酸盐协同作用,增强VSMC成骨转分化。我们的工作将HIF-1确定为ckd相关的早期病理事件、潜在的标志物以及在ckd相关条件下对抗血管钙化的潜在靶点。
内侧血管钙化(VC)是慢性肾脏疾病(CKD)的一个标志,与动脉内的钙磷酸盐沉积有关,会加剧血管僵硬和心血管疾病。这个高度调控的过程与骨骼发育和矿化有许多相似之处。驱动VC的一个关键事件是血管平滑肌细胞(VSMC)向骨样细胞表型的转分化。CKD导致的无机磷酸盐(HiPO4)升高是VSMC成骨细胞转分化的原因之一,并易导致VC.4经HiPO4处理的VSMC上调成骨激活因子,但失去了平滑肌肌动蛋白alpha-2
(ACTA2)和transgelin (TAGLN/SM22)等VSMC谱系标志物。5在VSMC成骨活化剂中,骨形态发生蛋白2
(BMP-2)对骨形成起重要作用,vc . 6,7,8 BMP-2信号通路增加了钙化促进因子2 (runt相关转录因子2
(RUNX2)的表达。RUNX2对骨细胞分化至关重要,是驱动VSMC成骨转分化和钙化的关键介质。2, 10
RUNX2在hipo4处理的VSMC和钙化的血管组织中上调。11、12
CKD中观察到的异常矿物质代谢、炎症和氧化应激等病理生理状态与vc . 13,14低氧(缺氧)有关,低血灌注和贫血导致的低氧(缺氧)也与CKD有关。虽然缺氧和VC之间没有直接的联系,但已有研究将缺氧诱导因子-1
(HIF-1)与VC. 19,20联系起来,因此,缺氧信号可能确实与VSMC成骨转分化导致VC有关。低氧信号主要通过HIF-1介导,HIF-1是vmsc中主要的低氧诱导转录因子。22
HIF-1是一个异质二聚体组成O2-sensitive HIF-1α和既定HIF-1β表示。23
HIF-1与靶基因上的低氧反应元件(HRE)结合,如血管内皮生长因子A (VEGFA)和葡萄糖转运体1型(glut1)。24
HIF-1α蛋白质稳定性由它控制氧依赖性退化域(ODDD)。ODDD包含关键的脯氨酸残基羟化的具体HIF-prolyl羟化酶(博士)在O2.25面前,26日博士羟基化允许识别HIF-1αVHL,冯Hippel-Lindau肿瘤抑制基因的产物。27、28
VHL指导泛素化和proteasome-dependent HIF-1α退化。29日在缺氧,HIF-1α羟基化受阻,停止HIF-1α退化和形成积极HIF-1
complex.30
由于缺氧信号对骨细胞分化具有重要作用,且骨与VC之间存在相似性,我们试图探讨缺氧在VSMC钙化中的作用。利用CKD相关条件下的细胞模型,我们证明缺氧能显著增强hipo4诱导的VSMC成骨转分化和钙化。我们的结果表明,这种效应是通过HIF-1介导的。我们还发现HIF-1在VSMC中被HiPO4快速诱导和激活,即使在O2存在的情况下也是如此。综上所述,我们认为HIF-1是hipo4诱导的VSMC钙化的重要中间体。
HiPO4激活HIF-1
在VSMC中,各种细胞外刺激独立于O2水平激活HIF-1。我们探讨了HiPO4单独治疗是否能激活VSMC中的HIF-1。令人惊讶的是,增加HIF-1α蛋白质水平检测后只有几个小时的HiPO4治疗20.9%
O2(图6)。然后我们相比HIF-1α蛋白质诱导HiPO4治疗期间有或没有缺氧。如图6所示,HiPO4强烈HIF-1α增加蛋白质含量(5.63±0.72折控制细胞20.9%
O2)。VSMC治疗HiPO4和1% O2显示HIF-1α蛋白质添加剂影响感应(2.42±0.60折/ HiPO4-treated细胞20.9% O2)(图6
b)。这些结果清楚地表明,VSMC对待HiPO4
HIF-1α增加蛋白质含量在含氧或缺氧环境。然后我们研究HiPO4治疗是否可以通过使用HIF-1敏感的报告基因产生转录活性的HIF-1复合物。在20.9%
O2中,HiPO4处理的VSMC的HRE报告活性增加到1% O2中观察到的水平(在20.9%
O2中,HRE报告活性是对照组细胞的1.94±0.07倍)(图6c)。采用VEGFA和GLUT-1检测HiPO4处理对HIF-1靶基因表达的影响。与报告分析结果一样,在20.9%
O2中,HiPO4处理VSMC后,VEGFA和glut1 mRNA的表达水平与在低氧条件下观察到的水平相当(在20.9% O2中,VEGFA和glut1
mRNA的表达分别是对照组细胞的1.62±0.14和1.86±0.23倍)(图6d)。与HIF-1α蛋白质含量,VSMC HiPO4和1% O2
HIF-1目标基因调控的累加效应。确认的含义在HiPO4-induced HIF-1 VSMC响应,我们与一个特定的目标HIF-1α小干扰RNA
(siRNA)。作为控制核相比,siHIF1A有效减少HIF-1αVSMC的蛋白质水平处理HiPO4 1% O2和钝化VEGFA GLUT-1
mRNA表达VSMC(补充图S6A)。综上所述,我们的结果表明HiPO4是VSMC中HIF-1复合物的一种高效、快速的激活剂,提示这些信号通路在CKD中对MI反应的功能上具有重要意义。
讨论
CKD过程中VC的发展是一个高度调控的过程,涉及多个因素的复杂相互作用。虽然已知HiPO4在CKD期间与VSMC钙化有关,但特定的信号通路有助于其进展。VC与骨形成有相似之处是公认的。2,
9有趣的是,低氧信号在维持血管张力和骨发育中起着关键作用,而异常信号则会导致心血管疾病和骨缺损。44,45项研究表明,缺氧和HIF-1信号通路与肾脏疾病密切相关,这使我们认为它们在VC.
15,16中的潜在意义。我们描述了低氧和HiPO4在主动脉内钙化过程中的协同作用,并确定HIF-1是主要的功能因子。
不同的血管床是ckd钙化的靶点。46多种机制与HiPO4协同作用,诱导VSMC钙化,如炎症和氧化应激。在这里,我们的研究集中在主动脉钙化上,因为它是导致患者动脉硬化、收缩期高血压和心脏负荷增加的主要原因。1,2我们认为HIF-1的激活也可以作为VC的一般介质,因为许多钙化机制也可以直接刺激HIF-1信号,或通过HIF-1信号被激活。最近的研究表明HIF-1α表达之间的相关性和VC。等离子体HIF-1α高架在糖尿病患者冠状动脉钙化,而calcitriol-treated老鼠显示增加骨质疏松HIF-1αprotein-induced
VC.19,这些研究表明,20
procalcifying条件增加HIF-1信号在VC。因此,我们证实了HIF-1和靶基因VEGFA和glut1在CKD大鼠钙化主动脉中的表达增加。综上所述,这些研究强调了HIF-1/缺氧信号机制在VC中的中心作用。然而,值得注意的是,目前的小鼠转基因模型是VC进展研究的技术限制。47,48为了充分阐明缺氧/HIF-1在这一重要病理状态中的作用,需要开发对mi诱导的VC敏感的新型动物模型。
我们研究了缺氧/HIF-1信号通路对VSMC成骨细胞转分化和钙化的刺激作用。我们的研究清楚地表明,缺氧和HIF-1激活因子在HiPO4条件下上调骨相关标志物,这与缺氧对骨发育的影响相似。45
HIF-1似乎通过增加VSMC成骨分化主调控因子RUNX2的表达来调节VC。在这项研究中,我们描述一个VSMC-specific
HIF-1α缺失严重的损害RUNX2表达在正常和低含氧条件。先前的研究已经建立RUNX2的决定性因素在VC.49
VSMC重组,50个有趣的是,RUNX2与HIF-1α成骨细胞和控制其稳定性,从而调节HIF-1转录活动。这种相互作用表明,在hipo4诱导的VSMC表型转变过程中,存在一个调节HIF-1活性的正反馈环。未来的研究将很重要,以调查这种可能性。
我们的工作首次证明HiPO4是一种新的HIF-1激活剂,并验证了HIF-1在VC中的早期功能作用。hipo4诱导的HIF-1激活导致靶基因表达,包括关键的血管生成因子VEGF。VEGF在成骨细胞前体细胞中表达,已知可促进成骨细胞分化和骨形成。此外,RUNX2调控VEGF表达。51,58提出了RUNX2与VEGF之间的正反馈回路,VEGF通过胞内机制刺激RUNX2表达。然而,HIF-1和/或VEGF增加RUNX2的机制仍不清楚。我们认为在HiPO4治疗过程中,HIF-1激活可以表达VEGF等特异性基因,并通过RUNX2激活上调VSMC成骨转分化。需要进一步的研究来明确这一假设。
我们表明,HiPO4-induced
HIF-1激活发生在HIF-1α亚基稳定。HiPO4稳定HIF-1α通过阻断VHL绑定和大概,HIF-1α羟基化。重要的代数余子式HIF-1α羟化酶包括O2、2-oxoglutarate价和抗坏血酸盐。我们发现HiPO4增加了mtROS水平,导致抗坏血酸水平下降。有趣的是,氧化的抗坏血酸可由GLUT-1.60家族成员转运,即GLUT-1.60。因此,在hipo4处理的VSMC中,glut1可能参与调节抗坏血酸水平。我们之前的研究显示,MI.31大鼠主动脉钙化后氧化应激增加,有趣的是,BMP-2也受氧化应激上调,而H2O2促进RUNX2表达和VSMC钙化。61年、62年、63年因为mtROS代VSMC
HiPO4期间对HIF-1α稳定至关重要,我们的研究强调ROS的核心作用CKD-related钙化。
不可否认,VC是一个高度调控的过程,涉及多种因素的复杂表现。由于HIF-1在血管生物学中具有重要作用,且HIF-1的不良活化与多种心血管疾病相关,我们认为HIF-1信号通路与CKD中VSMC钙化具有功能相关性。我们的研究揭示了缺氧和HiPO4对VSMC钙化的强协同作用,并将HIF-1作为这一作用的重要中介。此外,我们认为HiPO4是一种新的HIF-1诱导剂和激活剂。缺氧状态下HiPO4中HIF-1的快速表达进一步增强,揭示了HiPO4诱导的VC中潜在的初始信号通路。HiPO4和缺氧之间的这种动态关系反映在长时间缺氧处理导致VSMC钙化增强的过程中。综上所述,我们的工作为理解持续的HIF-1激活如何导致VSMC向成骨表型转变和随后的钙化提供了初步线索。我们坚信HIF-1是这些钙化的一个有趣和有吸引力的标记和靶点,可能阐明CKD的早期病理事件。我们的发现对于了解患有贫血、生活在更高海拔或正在接受PHD抑制剂治疗的CKD患者的异常反应具有重要意义。我们认为最后一点特别及时,因为这些抑制剂目前正在CKD患者的高级临床试验中进行研究。37、38
Hypoxia-inducible factor-1 plays a role in
phosphate-induced vascular smooth muscle cell calcification
Medial vascular calcification is a common complication of chronic kidney disease
(CKD). Although elevated inorganic phosphate stimulates vascular smooth muscle
cell (VSMC) osteogenic transdifferentiation and calcification, the mechanisms
involved in their calcification during CKD are not fully defined. Because
hypoxic gene activation is linked to CKD and stimulates bone cell osteogenic
differentiation, we used in vivo and in vitro rodent models to define the role
of hypoxic signaling during elevated inorganic phosphate-induced VSMC
calcification. Cell mineralization studies showed that elevated inorganic
phosphate rapidly induced VSMC calcification. Hypoxia strongly enhanced elevated
inorganic phosphate-induced VSMC calcification and osteogenic
transdifferentiation, as seen by osteogenic marker expression. Hypoxia-inducible
factor-1 (HIF-1), the key hypoxic transcription factor, was essential for
enhanced VSMC calcification. Targeting HIF-1 expression in murine VSMC blocked
calcification in hypoxia with elevated inorganic phosphate while HIF-1
activators, including clinically used FG-4592/Roxadustat, recreated a
procalcifying environment. Elevated inorganic phosphate rapidly activated HIF-1,
even in normal oxygenation; an effect mediated by HIF-1α subunit stabilization.
Thus, hypoxia synergizes with elevated inorganic phosphate to enhance VSMC
osteogenic transdifferentiation. Our work identifies HIF-1 as an early
CKD-related pathological event, prospective marker, and potential target against
vascular calcification in CKD-relevant conditions.
Hypoxia-inducible factor-1 plays a role in phosphate-induced vascular smooth
muscle cell calcification - ScienceDirect
https://www.sciencedirect.com/science/article/abs/pii/S0085253816302381
Hypoxia-inducible factor-1 plays a role in phosphate-induced vascular smooth
muscle cell calcification - Kidney International
https://www.kidney-international.org/article/S0085-2538(16)30238-1/fulltext
焦磷酸盐缺乏导致血管钙化
摘要
病理性心血管钙化与多种疾病有关,是慢性肾脏疾病的常见并发症。由于环境钙和磷酸盐水平以及血管基质的性质即使在正常情况下也有利于钙化,因此焦磷酸盐等内源性抑制剂在预防中起着关键作用。遗传疾病和动物模型阐明了细胞外焦磷酸盐的代谢,证明了焦磷酸盐缺乏对血管钙化的重要性。以焦磷酸盐代谢为基础的治疗方法已在包括肾衰竭在内的动物模型中得到了有效的应用,并有望成为未来预防血管钙化的治疗方法。
Pyrophosphate deficiency in vascular calcification.
Abstract
Pathologic cardiovascular calcification is associated with a number of
conditions and is a common complication of chronic kidney disease. Because
ambient calcium and phosphate levels together with properties of the vascular
matrix favor calcification even under normal conditions, endogenous inhibitors
such as pyrophosphate play a key role in prevention. Genetic diseases and animal
models have elucidated the metabolism of extracellular pyrophosphate and
demonstrated the importance of pyrophosphate deficiency in vascular
calcification. Therapies based on pyrophosphate metabolism have been effective
in animal models, including renal failure, and hold promise as future therapies
to prevent vascular calcification.
Pyrophosphate deficiency in vascular calcification. - PubMed - NCBI
https://www.ncbi.nlm.nih.gov/pubmed/29580636
在磷酸盐诱导的钙化过程中,血管平滑肌细胞中细胞外焦磷酸盐的合成增加
目的-羟基磷灰石沉积在主动脉壁内侧层是血管钙化的标志,是老年人、糖尿病患者和血液透析患者最常见的并发症。细胞外焦磷酸盐是一种有效的羟基磷灰石晶体形成的物理化学抑制剂。本研究分析了磷酸盐诱导钙化过程中细胞外焦磷酸盐代谢的变化。方法和结果-磷酸盐诱导体外培养的主动脉环钙化,7天后导致钙的积累。当主动脉壁失活时,这种积累会增强。BMP2(骨形态发生蛋白2)的表达与培养的主动脉环、血管平滑肌细胞(VSMCs)和降钙三醇诱导的大鼠钙化有关。羟基磷灰石剂量依赖性诱导VSMCs中BMP2过表达。此外,在研究的3个模型中,TNAP(组织非特异性碱性磷酸酶)mRNA水平和活性均在早期下调,在钙化后期上调。eNPP1
(ectonucleotide焦磷酸酶/磷酸二酯酶1)在钙化早期至后期呈上升趋势,而eNTPD1 (ectonucleoside triphosphate
diphospho - hydrolase
1)在钙化后期呈下降趋势。在所研究的3种模型中,VSMCs中焦磷酸盐的合成均随时间显著增加。由于焦磷酸盐水解速率比焦磷酸盐合成速率慢10倍,所以焦磷酸盐合成主要由eNPP1与eNTPD1活性比值决定。羟基磷灰石在VSMCs中也能诱导TNAP和eNPP1/eNTPD1比值的增加。结论:由于细胞外焦磷酸盐代谢的代偿性调节,在磷酸盐诱导的钙化过程中,VSMCs中焦磷酸盐的合成增加。
Synthesis of Extracellular Pyrophosphate Increases in Vascular Smooth Muscle
Cells During Phosphate-Induced Calcification.
Objective- Hydroxyapatite deposition on the medial layer of the aortic walls is
the hallmark of vascular calcification and the most common complication in aging
individuals and in patients with diabetes mellitus and those undergoing
hemodialysis. Extracellular pyrophosphate is a potent physicochemical inhibitor
of hydroxyapatite crystal formation. This study analyzed changes in
extracellular pyrophosphate metabolism during the phosphate-induced
calcification process. Approach and Results- Phosphate-induced calcification of
ex vivo-cultured aortic rings resulted in calcium accumulation after 7 days.
This accumulation was enhanced when aortic walls were devitalized. BMP2 (bone
morphogenic protein 2) expression was associated with calcium accumulation in
cultured aortic rings, as well as in cultured vascular smooth muscle cells
(VSMCs) and in calcitriol-induced calcification in rats. Hydroxyapatite dose
dependently induced BMP2 overexpression in VSMCs. Moreover, TNAP (tissue
nonspecific alkaline phosphatase) mRNA levels and activity were found to be
downregulated in early phases and upregulated in later phases of calcification
in all 3 models studied. eNPP1 (ectonucleotide pyrophosphatase/phosphodiesterase
1) increased from early to later phases of calcification, whereas eNTPD1
(ectonucleoside triphosphate diphosphohydrolase 1) was downregulated during
later phases. Synthesis of pyrophosphate in VSMCs increased significantly over
time, in all 3 models studied. Because the rate of pyrophosphate hydrolysis was
10× slower than the rate of pyrophosphate synthesis, pyrophosphate synthesis is
determined mainly by the ratio of eNPP1 to eNTPD1 activity. Hydroxyapatite also
induces increments both in TNAP and eNPP1/eNTPD1 ratio in VSMCs. Conclusions-
Pyrophosphate synthesis increases in VSMCs during phosphate-induced
calcification because of compensatory regulation of extracellular pyrophosphate
metabolism.
Synthesis of Extracellular Pyrophosphate Increases in Vascular Smooth Muscle
Cells During Phosphate-Induced Calcification. - PubMed - NCBI
https://www.ncbi.nlm.nih.gov/pubmed/30002059
细胞外核苷酸抑制动脉内钙化和骨矿化:不同细胞机制介导的相同功能作用。
动脉中层钙化(AMC)被认为与骨骼矿化有一些表面上的相似性,并与血管平滑肌细胞(VSMCs)向成骨细胞样表型的转分化有关。ATP和UTP已经被证明可以抑制骨矿化。本研究比较了细胞外核苷酸对VSMCs和成骨细胞钙化的影响。ATP、UTP和普遍存在的矿化抑制剂焦磷酸盐(PPi)剂量依赖性抑制VSMC钙化≤85%。在钙化条件下培养VSMCs与细胞凋亡增加有关;ATP、UTP和PPi的治疗降低了非钙化细胞的凋亡水平。
细胞外核苷酸对成骨细胞存活率无影响。成骨细胞碱性磷酸酶(TNAP)活性是VSMCs的100倍以上。ATP和UTP降低成骨细胞TNAP活性(≤50%),而刺激VSMC TNAP活性(≤88%)。细胞外核苷酸对VSMC钙化、细胞活力和TNAP活性的影响不因P2Y2受体的缺失或抑制而改变。相反,在缺乏P2Y2受体的成骨细胞中,ATP/UTP对骨矿化和TNAP活性的作用减弱。外核苷焦磷酸酶/磷酸二酯酶1 (NPP1)水解ATP和UTP产生PPi。在VSMCs和成骨细胞中,NPP1的缺失减弱了细胞外核苷酸的抑制作用,表明P2受体独立通路参与其中。
我们的结果表明,尽管细胞外核苷酸对AMC和骨矿化的整体功能影响相似,但在介导这些作用的细胞机制上存在明显差异。
Inhibition of arterial medial calcification and bone mineralization by
extracellular nucleotides: The same functional effect mediated by different ...
- PubMed - NCBI
https://www.ncbi.nlm.nih.gov/pubmed/28976001
新的磷酸盐活化巨噬细胞通过增加细胞外ATP和焦磷酸盐来防止异位钙化
Novel phosphate-activated macrophages prevent ectopic calcification by
increasing extracellular ATP and pyrophosphate
目的
磷是许多病理生物学过程中必不可少的营养物质。只有不到1%的磷以无机磷酸盐离子(Pi)的形式存在于细胞外液中。高血清Pi水平促进包括血管在内的许多组织的异位钙化。在这里,我们研究了Pi浓度升高对巨噬细胞极化和钙化的影响。巨噬细胞存在于几乎所有的组织中,在健康和疾病中发挥着关键作用,并显示出显著的可塑性,能够根据环境提示改变生理机能。
方法和结果
高通量转录组分析和功能研究表明Pi诱导非极化巨噬细胞采用与交替活化的M2巨噬细胞相似的表型,如精氨酸水解、能量和抗氧化谱所示。pi诱导的巨噬细胞显示出一种抗钙化作用,这是由细胞外ATP和焦磷酸盐的增加介导的。
结论
我们认为pi活化巨噬细胞阻止钙磷沉积的能力是一种保护组织免受高磷诱导的病理钙化的代偿机制。
Fig 7. Increased release of ATP and PPi to the extracellular environment by
Pi-activated macrophages protects tissues against Pi-induced calcification.
活化巨噬细胞向细胞外环境释放更多ATP和PPi,保护组织免受pi诱导的钙化。
介绍
磷是许多生物过程中必不可少的营养素,包括细胞信号、核酸合成、能量代谢、膜功能和骨矿化。磷存在于硬组织(约85%)、软组织(约14%)和细胞外液(约1%)中。细胞外液中的磷主要以游离磷酸盐离子的形式存在于溶液中,称为无机磷酸盐(Pi)。血浆Pi浓度为0.8-1.5
mmol/L,以三种形式存在:与蛋白质结合、与阳离子络合和电离。血清磷酸盐浓度是肠道吸收磷酸盐、骨动员磷酸盐和尿中肾排泄磷酸盐平衡的结果。磷酸盐稳态主要由维生素D、甲状旁腺素(PTH)、成纤维细胞生长因子23
(FGF23)[3]等磷脂调节。
异常高的血清磷酸盐是一种病理状态称为高磷酸盐血症。高磷血症可由以下原因引起:1)磷酸盐摄入量增加(如灌肠或维生素D中毒);2)磷酸盐排泄减少(与肾功能衰竭和甲状旁腺功能减退有关);急性高磷血症可引起心肌、肺等软组织钙化,偶尔也可引起肝血钙。相反,慢性高磷血症促进许多组织的钙化,特别是血管、肾脏、骨骼、皮肤、关节和心脏[6]。长期以来,磷酸盐升高一直被认为是慢性肾病(CKD)[7]患者全因和心血管疾病死亡的主要危险因素。此外,近年来,这一观察已扩展到普通人群,其中血清磷酸盐与冠状动脉粥样硬化的严重程度、颈动脉内膜增厚和左心室肥厚有关[8,9]。
巨噬细胞几乎存在于所有组织中,具有免疫功能和重要的稳态作用,如红细胞清除[10]。组织驻留巨噬细胞统称为单核吞噬细胞系统。所有这些髓系细胞都有特定的名称,具体名称取决于它们的位置,如肝脏中的库普弗细胞、皮肤和粘膜中的朗格汉斯细胞、结缔组织中的组织细胞、中枢神经系统中的小胶质细胞和骨中的破骨细胞[11-14]。巨噬细胞表现出明显的可塑性,可根据环境提示[15]改变生理机能,产生功能不同的细胞群[16]。例如,tissue-resident单核细胞被激活TH1、TH2细胞因子分别形成M1φs
M2φs,被认为代表了极端异构频谱的巨噬细胞[17]子集。其他巨噬细胞亚型包括氧化磷脂活化的Mox、cxcl4活化的M4和血红蛋白活化的M(Hb)巨噬细胞[18,19]。
年龄依赖性血管钙化是与心血管疾病相关的病态性的主要独立预测因子[8,9]。内膜钙化是动脉粥样硬化的一个常见过程,与粥样硬化斑块[20]富含脂质区域巨噬细胞的存在有关;此外,动脉粥样硬化进展的不同阶段与不同的巨噬细胞亚型[21]的存在有关。目前流行的观点是巨噬细胞通过释放诱导血管平滑肌细胞(VSMCs)成骨分化和矿化的物质来促进内膜钙化[22,23]。然而,最近的一份报告表明,替代性活化巨噬细胞(M2φs) anti-calcifying活动不是由classically-activated引起巨噬细胞(M1φs) [24]。由于高磷血症是易于钙化的常见情况,本研究分析高Pi浓度是否刺激巨噬细胞活化以及Pi诱导的巨噬细胞对异位钙化的影响。
Novel phosphate-activated macrophages prevent ectopic calcification by
increasing extracellular ATP and pyrophosphate
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0174998
镁和ATP(三磷酸腺苷稳)定无定形磷酸钙
在溶液中同时使用镁和三磷酸腺苷(ATP),可以延缓非晶态磷酸钙(ACP)浆液向晶态羟基磷灰石(HA)的转化,具有协同作用。在某些情况下,转化延迟的时间是单独使用ATP或Mg的10倍以上。在所有的实验中,直到溶液中的ATP通过水解降低到无法检测的水平,转化才开始。Mg的作用是大幅度降低ATP水解的速率。一旦转化开始,在Mg和ATP的存在下,其过程比单独使用Mg或ATP时要慢。ATP也被发现可以防止钙和磷酸盐的亚稳态溶液中不含任何固相HA的形成。在这些实验中,ATP在Tris-HCl缓冲液和Ca、PO4、Ca
+
PO4离子溶液中的水解程度可以忽略不计。ATP的水解确实发生在ACP或HA存在的情况下,可能是通过固体磷酸钙相表面的转磷酸酶化。结果表明,ATP稳定ACP,不是通过影响其溶解作用,而是通过毒害异核生长位点,或在胚胎HA核达到临界大小前毒害其生长(形成的核形态或均质或均质),或同时毒害两者。在胚胎HA核的情况下,中毒的核会回到溶液中,阻止HA晶体的形成。此外,还发现中性的Ca9(PO4)6簇被认为是ACP的基本结构单元,当ACP在水溶液中溶解时,会分解成单个的Ca和PO4离子。
镁和ATP稳定无定形磷酸钙
Stabilization of amorphous calcium phosphate by Mg and ATP
Authors
A synergistic effect has been demonstrated when magnesium and adenosine
triphosphate (ATP) are used together in solution to delay the conversion of a
slurry of amorphous calcium phosphate (ACP) to crystalline hydroxyapatite (HA).
Conversion is delayed in some instances more than 10 times as long as with
either ATP or Mg alone. In all experiments conversion did not begin until ATP in
solution had decreased through hydrolysis to an undetectable level. The effect
of Mg is to decrease substantially the rate at which ATP hydrolysis occurs. Once
conversion began it proceeded more slowly in the presence of both Mg and ATP
than with Mg or ATP alone. ATP was also found to prevent the formation of HA
from metastable solutions of calcium and phosphate which did not contain any
solid phase. Over the time period of these experiments, ATP hydrolyzed to a
negligible extent in Tris-HCl buffer and in solutions containing Ca, PO4, and Ca
plus PO4 ions. Hydrolysis of ATP does occur in the presence of ACP or HA,
presumably by transphosphorylation on the surface of the solid calcium phosphate
phase. It was concluded that ATP stabilized ACP, not by affecting its
dissolution, but either by poisoning heteronuclear growth sites, or by poisoning
the growth of embryonic HA nuclei (formed heterogeneously or homogeneously)
before their critical size is reached, or by poisoning both. In the case of
embryonic HA nuclei, the poisoned nuclei would go back into solution preventing
HA crystal formation. In addition, it was found that the neutral Ca9(PO4)6
clusters, which are believed to be the basic structural unit of ACP, break down
into individual Ca and PO4 ions when ACP dissolves in aqueous medium.
Stabilization of amorphous calcium phosphate by Mg and ATP | SpringerLink
https://link.springer.com/article/10.1007%2FBF02012793
钙在细胞凋亡中的作用
关于钙在细胞凋亡中的作用的描述,主要集中在内质网和线粒体。
细胞凋亡是一种高度调控的细胞死亡机制,在细胞发育和组织稳态中起重要作用。凋亡可以通过外部途径发生,配体与细胞表面的死亡受体结合,也可以通过涉及线粒体的内部途径发生。
了解更多关于细胞凋亡的途径
这两种途径都集中在caspases的激活上,caspases会分裂细胞骨架蛋白和核膜层,并促进DNA降解。
很明显,Ca2+浓度的细微变化可以调节和触发细胞凋亡。在这里,我们描述了Ca2+如何通过促进线粒体释放促凋亡因子和随后的caspase激活,在内在凋亡通路中发挥重要作用。
Ca2+在内质网(ER)和线粒体之间的移动
ER是重要的Ca2+存储细胞器,与细胞溶胶和线粒体基质中的100 nM相比,其浓度维持在0.1-1 mM (Hajnoczky et al.,
2003)。释放这种储存的Ca2+并随后被线粒体吸收是一种可以触发细胞凋亡的机制。
肌醇三磷酸(IP3)受体介导的Ca2+从内质网释放,通过内质网和线粒体的局部相互作用将Ca2+传递到周围的线粒体。当ER适当折叠蛋白质的能力受到损害时,这种释放可以被ER应激触发(Orrenius
et al., 2003)。
或者,在Boehning等人(2003)提出的正反馈机制中,少量的细胞色素c在凋亡刺激下从线粒体中释放出来,随后与表面或内质网的IP3受体结合,触发钙的释放。
线粒体内Ca2+的积累通过刺激线粒体通透性转变孔的开放导致线粒体膜通透性(mPTP, Orrenius et al.,
2003)。mPTP的开放导致促凋亡因子的释放,特别是细胞色素c的释放。
BCL-2蛋白在Ca2+介导的细胞凋亡中的作用
BCL-2家族蛋白是细胞凋亡调控的核心。它们可分为抗凋亡的如BCL-2和BCL-xL,以及促凋亡的如BAX、BAK和BAD等。
BCL-2蛋白与线粒体有关,它们参与改变细胞膜通透性,调节细胞色素c和其他促凋亡因子的释放(Chipuk et al.,
2010)。然而,它们也与ER相关,有证据表明它们在调节细胞膜上的Ca2+通量方面有作用。
抗凋亡蛋白BCL-2的表达通过降低内质网Ca2+负荷,减少内质网Ca2+的释放和线粒体的后续摄取(Pinton et al.,
2000;或通过直接与IP3受体相互作用,降低通道打开的概率(Rong et al., 2008)。
BCL-2蛋白家族中促凋亡的成员也参与了Ca2+依赖的凋亡。BAX和BAK控制内质网和线粒体内Ca2+稳态,促进线粒体钙摄取(Scorrano等,2003;纳特等人,2002)。此外,BAD和tBID已被证明对Ca2+敏感的线粒体使他们更容易从ER
Ca2+释放(Roy et al., 2009;Csordas等人,2002)。
Calcium signaling in apoptosis | Abcam
https://www.abcam.com/cancer/calcium-signaling-in-apoptosis
Endoplasmic reticulum stress: cell life and death decisions
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1236697
Oct 01, 2005 · ER stress and diseases. ER stress is associated with a range of
diseases, including ischemia/reperfusion injury, neurodegeneration, and diabetes
(reviewed in ref. 44 ), making ER stress a probable instigator of pathological
cell death and dysfunction.
379/5000
内质网应激:决定细胞的生死
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1236697
2005年10月1日内质网应激与一系列疾病相关,包括缺血/再灌注损伤、神经退行性变和糖尿病(见文献44),使内质网应激可能是病理性细胞死亡和功能障碍的诱因。
内质网应激:决定细胞的生死
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1236697
·Parkin的表达是由内质网应激诱导的,提示其在适应内质网应激中的作用,可能在内质网相关蛋白降解途径中起清除错误折叠蛋白的作用。与包涵体形成和蛋白聚集相关的神经退行性疾病也与内质网应激相关,包括肌萎缩性脊髓侧索硬化症、帕金森病、亨廷顿舞蹈症、…
镁可以防止磷酸盐引起的…
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3611891
·血管钙化(VC)在慢性肾病患者中普遍存在。促进钙化的因素包括矿物质代谢异常,特别是高磷酸盐水平。无机磷酸盐(Pi)是体外VC的经典诱导剂。近年来,血清镁浓度与VC呈负相关关系。
Magnesium prevents phosphate-induced calcification in ...
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3611891
Dec 09, 2012 · Vascular calcification (VC) is prevalent in patients suffering
from chronic kidney disease. Factors promoting calcification include
abnormalities in mineral metabolism, particularly high phosphate levels.
Inorganic phosphate (Pi) is a classical inducer of in vitro VC. Recently, an
inverse relationship between serum magnesium concentrations and VC has been
reported.
镁治疗血管钙化
镁可以防止Klotho基因敲除小鼠的血管钙化,而代价是骨软化。(在出版社,2019年)。
在血管平滑肌细胞培养中,镁可以防止血管钙化。我们的发现表明,镁可以抑制晶体的形成,从而防止钙化。(Sci报告,2018)。
文献研究表明,许多研究支持血清镁和心血管疾病风险之间的联系。大量的体外和体内研究已经确定了镁在血管钙化中的保护作用。(动脉搭桥术。,2017)。
Magnesium treatment for vascular calcification
Magnesium prevents vascular calcification in Klotho knockout mice, at the
expense of osteomalacia. (In press, 2019).
Magnesium was shown to prevent vascular calcification in vascular smooth muscle
cell cultures. Our findings indicate that magnesium inhibits crystal formation
and thereby prevents calcification. (Sci reports, 2018).
Literature research indicates that many studies support an association between
serum magnesium and cardiovascular disease risk. A substantial body of in vitro
and in vivo studies has identified a protective role for magnesium in vascular
calcification. (Arterioscler Thromb Vasc Biol., 2017).
Magnesium treatment for vascular calcification - Radboudumc
https://www.radboudumc.nl/en/research/research-groups/magnesium-in-health-and-disease/discoveries/magnesium-treatment-for-vascular-calcification