透明质酸和心脏再生
Hyaluronic acid boosts cardiac regeneration
摘要
透明质酸(HA)在几种人体组织中大量表达,并强调了HA的多种作用。与组织修复特别相关的是,HA在组织损伤过程中会产生,这在伤口愈合研究中得到了广泛证明。在心脏中,血凝素参与生理功能,如胚胎发生时的心脏发育,以及动脉粥样硬化和心肌梗死等病理状态。此外,由于其相关的生物学特性,HA被广泛用作心肌梗死后心脏再生的生物材料。事实上,透明质酸及其衍生物具有生物可降解性和生物相容性,促进受伤组织的快速愈合,并在相关过程中支持细胞,包括生存、增殖和分化。由于在心肌梗死的临床前模型中获得的益处,可注射的基于ha的心血管疾病治疗正受到越来越多的关注。以ha为基础的水凝胶,特别是作为干细胞的载体,已被证明可以通过刺激血管生成、减少炎症、支持局部和移植物细胞的修复功能来改善心脏修复过程。固态ha型支架也被研究用于制造可将间充质干细胞或内皮祖细胞移植到心脏梗死表面的支架。最后,应用体外机械拉伸,在HA-based
3D支架中生长的干细胞可以进一步增加细胞外基质的产生和向肌肉表型分化的倾向性,从而为构建合适的心肌再生工程组织提供了潜在的策略。
介绍
透明质酸(或透明质酸,HA)是一种天然多糖,广泛分布于低等生物,如细菌[1],[2],到复杂的真核生物[3]。HA与胶原蛋白一起,是细胞外基质(ECM)最丰富的成分之一。non-sulfated,高分子量粘多糖组成的重复聚合葡萄糖醛酸和N-acetyl-glucosamine双糖的共轭glucuronidicβ(1→3)债券和hexosaminidicβ(1→4)连接[4]。HA的聚合结构包含2.5万个重复的双糖,其分子量约为4000
kDa。在细胞中,HA由质膜内表面的膜结合合成酶(has1[5]、has2[6]、has3[7])产生,其链通过孔状结构在ECM中释放。
在透明质酸酶(透明质酸酶1-5和透明质酸p1)的作用下,n
-乙酰氨基葡萄糖和葡萄糖醛酸残基之间的键被水解,从而导致HA降解,同时也水解了软骨素和皮肤硫酸盐的糖苷键[8]。
透明质酸以可溶性形式存在于ECM中,并以共价结合多种蛋白,如蛋白多糖(brevican、neurocan、versican)[9]和SHAP(血清来源的透明质酸相关蛋白)[10],通常被称为玻璃粘附蛋白。此外,HA与水形成可逆的连接,对关节和软组织[11]的润滑和压缩强度有特定的贡献。
HA也是激活细胞内信号级联的几种膜受体的配体。其中包括CD44、RHAMM(透明质酸介导的运动表达蛋白受体)、LYVE-1(淋巴管内皮透明质酸受体-1)、HARE(透明质酸内吞受体)[12]和toll样受体[13]。CD44是主要的细胞表面HA受体,虽然它也可以结合其他ECM蛋白、生长因子和细胞因子[14]。大多数细胞表达CD44,包括成纤维细胞、平滑肌细胞、上皮细胞和免疫细胞,如中性粒细胞、巨噬细胞和淋巴细胞。HA-CD44相互作用通过调节细胞生长、发育、粘附和迁移活动发挥重要作用。HA片段化主要通过toll样受体参与炎症调节和免疫过程中的[15]。
在人类中,HA在多种组织中大量表达,其不同的作用已被广泛研究,特别是与血管生成[16]和癌症[17]相关的研究。HA在组织损伤后产生,并参与组织修复[18]、[19]。在这些条件下,HA具有更多的多分散、碎片化,低分子量形态占优势。HA的低分子量片段(LMW,
100-500 kDa),而非天然的高分子量HA分子(HMW, ~ 4000
kDa),可刺激炎症细胞[20],[21]。由于toll样受体的低分子量刺激和细胞因子和趋化因子的诱导,单核细胞、巨噬细胞和树突状细胞在受损组织中迁移和回家。这些receptor-activated信号级联涉及的核因子kappa-light-chain-enhancer激活B细胞(NF-kB)
/基质金属蛋白酶(MMPs)系统和骨髓分化主要响应基因(MyD88)[22](图1)。流明瓦也可以诱导成纤维细胞和myofibroblasts通过协同增殖并产生纤维化瘢痕CD44和生长因子受体介导的信号转导(评估)。具体来说,欧洲汇率机制(ezrin
radixin和moesin)蛋白家族/
merlin系统被描述负责增加的细胞增殖通过肌动蛋白的组织和其他细胞骨架蛋白,反过来,激活细胞外signal-regulated蛋白激酶1和2
(ERK1/2)导致的增强表达细胞周期蛋白[23]。
LMW也可视为促血管生成因子[24]。的确,血管内皮细胞(ECs)和血管平滑肌细胞(VSMCs)表达CD44和RHAMM受体可以与流明瓦刺激Ras /
Raf ERK1/2和蛋白激酶C
(PKC)通路,然后促进细胞迁移、增殖和血管形成[25](图1)。本地公顷产生相反的效果,因为它反血管增生的块属性和流明瓦的促炎效应[26]。有研究表明,HMW可聚集不同于LMW[27]诱导的细胞内信号通路的HA受体。天然HA可能激活一种蛋白磷酸酶(PP),使ERM和merlin去磷酸化,后者抑制Ras/ERK1/2途径[23]。天然HA也可以提高细胞存活率,例如通过刺激CD44[27]下游的PI3K
/Akt激酶(图1)。
HA的分子大小影响其在肿瘤细胞中的活性。例如,只有6-
40-mers而非天然血凝素能诱导CD44裂解[28],以CD44依赖的方式促进肿瘤细胞运动[29],或激活MMPs[30]。
血凝素在心脏中含量丰富,参与了许多生理功能,如胚胎发育时的心脏发育,以及动脉粥样硬化时的血凝素b1和心肌梗死时的血凝素b2。在梗死区域,显著的炎症反应增加了CD44在浸润性白细胞、创面成肌纤维细胞和血管细胞[34]中的表达。众所周知,心肌梗死后的心脏愈合平行于结缔组织置换,导致瘢痕。在这一过程中,可以在损伤组织[33]中检测到HA的早期增加。水量也逐渐增加,并与HA的积累有关。大约一个月后,疤痕完全形成,而仅仅六个月后,血凝素含量就开始下降。虽然这些改变有助于降低壁破裂的风险,但它们通常易导致病理性左心室(LV)重构和心力衰竭[36]。
结论
心肌梗死区域的再生是一种挑战,以减少收缩失败的风险,通常随之而来的病理重建的疤痕区域。利用生物材料和/或干细胞的组织工程方法代表了治愈心肌梗死后受损心脏的希望。HA可以作为一种修复细胞的载体,但更有用的衍生物因其较低的可降解性和增加的机械强度而受到青睐。当移植到梗死心脏时,ha支架通过促进细胞存活、减少炎症反应、增加新生血管、促进常驻或移植的干细胞的心血管承诺来改善心肌结构和功能参数(图3),尽管程度较低。基于ha的水凝胶显示了经导管技术注射的优势,而固态水凝胶通常需要开胸手术。然而,在调节水凝胶密度时必须小心,以避免注射区域的心肌组织网络撕裂,特别是在细胞同时交付时。另一方面,以编织或无纺布形式的透明质酸可作为心肌表面的补片,加强心肌瘢痕,并为持续的修复过程提供传递的干细胞。使用ha基支架移植的成体干细胞增加了它们的生存能力,并改善了其在移植物区域的保留,而cd44依赖的机制常常被认为可能是导致这些益处的原因。基于ha的支架的存在也促进了干细胞向心肌细胞表型的分化,特别是当与其他因素结合时,这些因素对心脏基因表达具有协同效应。
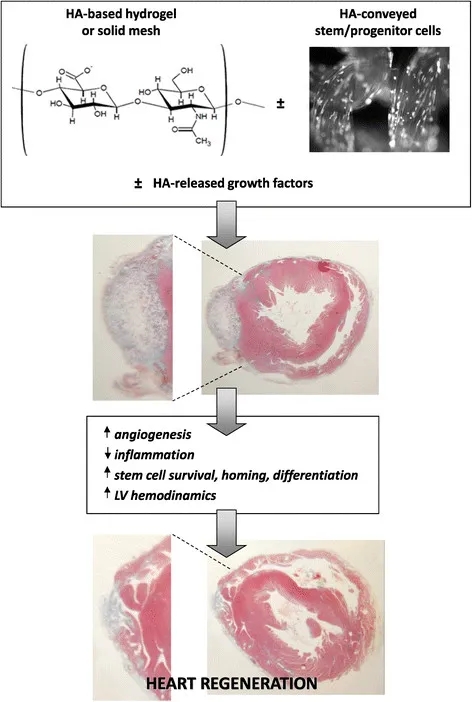
图3
基于ha的支架和移植的干细胞/祖细胞对心肌梗死后心脏再生的潜在影响。基于ha的生物材料可以作为水凝胶注射或作为固体补片移植,从而改善左心室(LV)的结构和功能。传递的干细胞/祖细胞和/或释放的生长因子可通过促进细胞存活、减少炎症反应、增加新生血管生成、有利于常驻或移植细胞的分化,进一步提高再生效能。
全尺寸图像
临床试验仅使用ha材料或细胞成分,以获得再生作用,主要用于伤口愈合和骨-关节修复。事实上,大多数的这些研究强调HA衍生品的好处,作为水凝胶或固体网格,施加在人类疾病,如静脉溃疡[107],[108],[109]褥疮性溃疡,口腔粘膜病变[110],痣/皮肤肿瘤的手术切除和cicatritial结果[111],talar圆顶和膝关节骨软骨病变[112],[113],颅骨骨再生[114]。到目前为止,还没有临床试验开始验证这种生物材料是否也可以用于修复梗死心肌。然而,在此综述的累积文献表明,基于ha的化合物是一种用于心脏组织工程的安全生物材料,它提供了一个合适的环境,能够提高存活和移植细胞的功能。
