肿瘤微环境导致了肿瘤的免疫逃逸
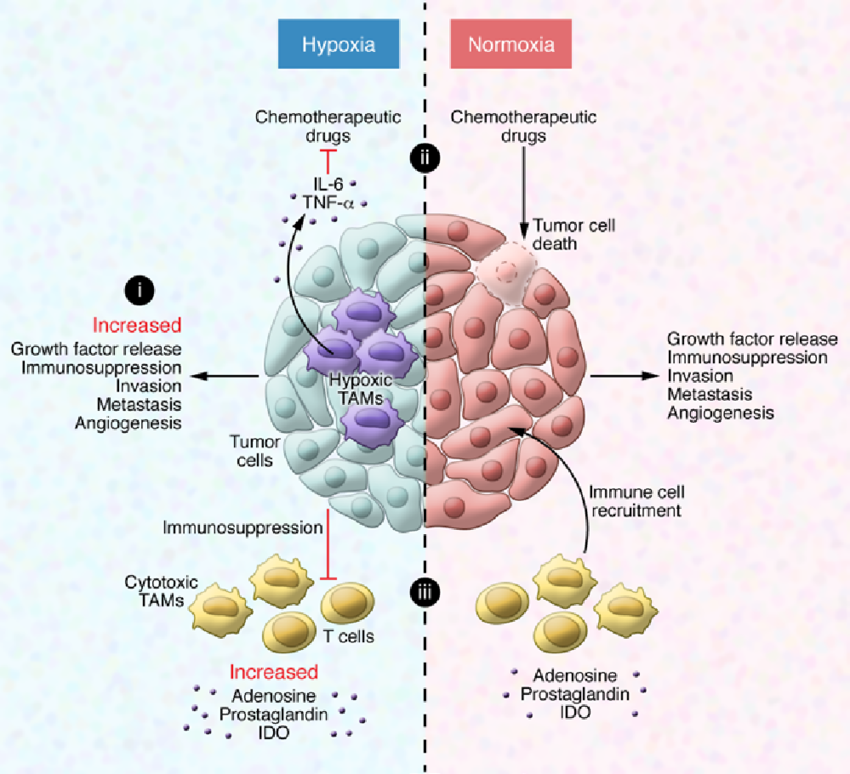
The impact of hypoxia on tumor-associated macrophages

Hypoxic regulation of TAMs in cancer progression and therapy. (i)
Hypoxia-induced release of chemoattractants results in enhanced TAM recruitment,
which further amplifies the protumoral response. (ii) TAMs release survival
factors for cancer cells, which protect them from chemotherapeutics. (iii) The
hypoxic tumor environment is immunosuppressive and prevents an antitumor
response.
Source publication
The role of tumor-associated macrophages (TAMs) in cancer is often correlated
with poor prognosis, even though this statement should be interpreted with care,
as the effects of macrophages primarily depend on their localization within the
tumor. This versatile cell type orchestrates a broad spectrum of biological
functions and exerts very complex and even opposing functions on cell death,
immune stimulation or suppression, and angiogenesis, resulting in an overall
pro- or antitumoral effect. We are only beginning to understand the
environmental cues that contribute to transient retention of macrophages in a
specific phenotype. It has become clear that hypoxia shapes and induces specific
macrophage phenotypes that serve tumor malignancy, as hypoxia promotes immune
evasion, angiogenesis, tumor cell survival, and metastatic dissemination.
Additionally, TAMs in the hypoxic niches within the tumor are known to mediate
resistance to several anticancer treatments and to promote cancer relapse. Thus,
a careful characterization and understanding of this macrophage differentiation
state is needed in order to efficiently tailor cancer therapy.
(PDF) The impact of hypoxia on tumor-associated macrophages
https://www.researchgate.net/publication/305786494_The_impact_of_hypoxia_on_tumor-associated_macrophages
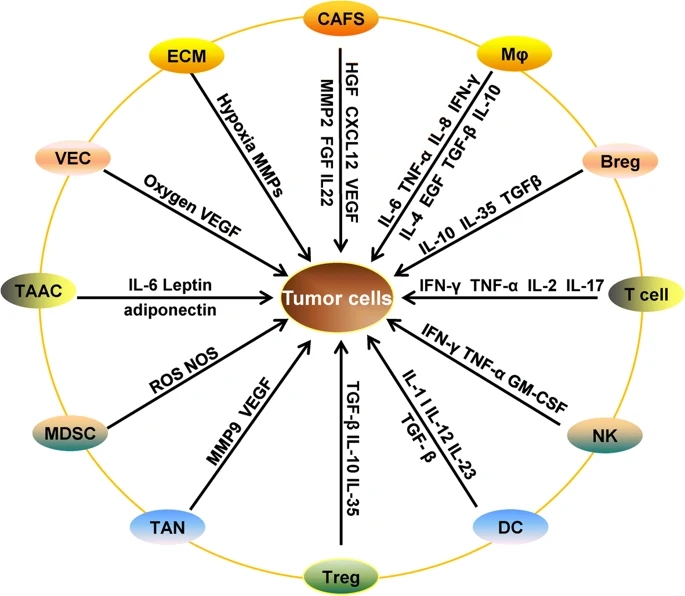
Role of the tumor microenivironment in PD-1/PD-L1 mediated immune escape
410013中南大学肿瘤发生与转化放射肿瘤学国家重点实验室,中南大学湘雅医学院附属肿瘤医院湖南肿瘤医院,湖南长沙410013
Hypoxia and Cancer | SpringerLink
https://link.springer.com/book/10.1007/978-1-4614-9167-5
低氧
在肿瘤特别是实体瘤的发生和发展过程中,不可能在肿瘤微环境中快速建立新的血管以适应肿瘤细胞的快速增殖。此外,新近建立的血管内存在结构和功能的异常。最终,肿瘤细胞的代谢导致以氧含量降低,营养缺乏和大量酸性物质的积累为特征的肿瘤微环境,这些条件对肿瘤细胞的生长极为不利[114,115,116,117,118]。但是,在缺氧的微环境中,肿瘤细胞可以通过改变糖酵解相关蛋白(例如GLUT1,GLUT3,PKM2和LDHA)的表达,改变其代谢模式以进行代谢重编程,从而最终增加葡萄糖的吸收和能量的产生[
119,120,121,122]。此外,通过改变E-钙粘蛋白,N-钙粘蛋白,Snail和波形蛋白的表达,这些EMT标记物来促进肿瘤细胞的侵袭和转移[123,124]。肿瘤免疫逃逸也是肿瘤细胞在这种低氧的微环境中生存的重要策略。
缺氧诱导因子(HIFs)是低氧环境中细胞诱导表达的最重要蛋白质。在正常氧气的作用下,脯氨酸羟化酶将HIF亚基保守区的脯氨酸残基羟化,并通过VHL E3泛素化连接酶鉴定并泛素化了HIF,从而使泛素化的HIF被蛋白酶体迅速降解[125]。然而,在缺氧条件下,HIF蛋白的脯氨酰羟化酶被抑制,从而稳定了HIFα的蛋白水平,从而诱导了其靶基因的表达,从而诱导了肿瘤的免疫逃逸[126]。 HIF主要通过诱导PD-L1的表达来诱导肿瘤免疫逃逸。在缺氧条件下,PD-L1的表达在T淋巴细胞,DC,MDSC和巨噬细胞,以及前列腺癌细胞,乳腺癌细胞和结肠直肠癌细胞中表达升高[127,128]。缺氧可增加PD-L1的表达并抑制CTL对肿瘤细胞的杀伤作用。缺氧诱导的PD-L1表达主要发生在转录水平。在乳腺癌和前列腺癌中,低氧诱导的PD-L1表达是通过HIF-1α而非HIF-2α实现的[128],在MDSC中也获得了类似的结果。免疫沉淀和荧光素酶报告基因实验证实,HIF-1α可以通过与PD-L1启动子上的HRE位点结合来激活PD-L1的转录[127]。然而,在透明细胞肾细胞癌中,PD-L1的诱导表达主要通过HIF-2α而非HIF-1α发生[129]。这种差异可能与细胞类型有关,因为超过90%的患有透明细胞肾细胞癌的患者会出现纯净的VHL蛋白纯合失活,这是HIF连接酶亚基的E3泛素化连接酶。这种失活导致细胞中高水平的HIF蛋白积聚[130]。另外,其他研究建议宿主HIF间接调节PD-L1,因为GLUT1和PD-L1的表达水平在低氧状态下显示出很强的相关性。然而,具体的作用机制仍有待阐明[131]。
Role of the tumor microenvironment in PD-L1/PD-1-mediated tumor immune escape
| Molecular Cancer | Full Text
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-018-0928-4
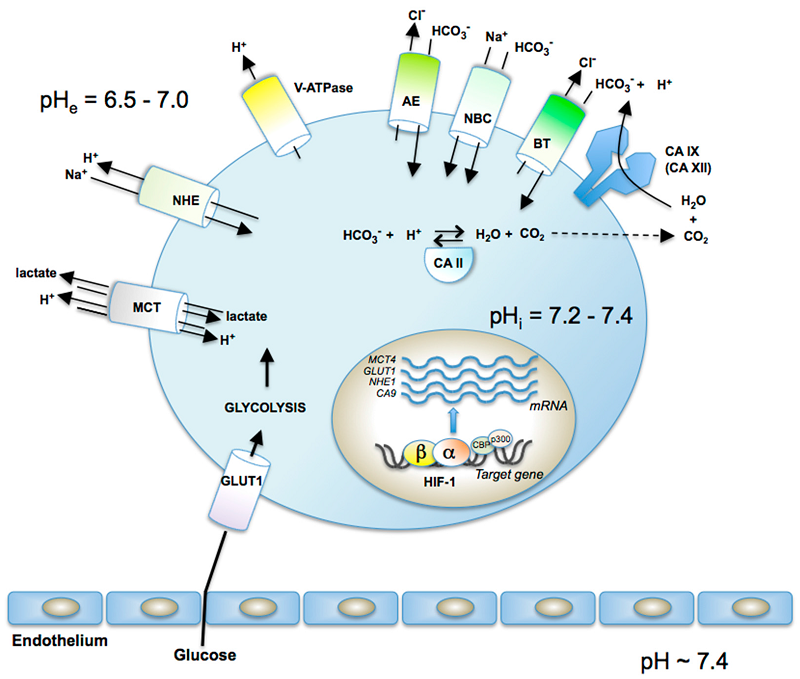
碳酸酐酶IX:从生物学到治疗方法
Carbonic Anhydrase IX: From Biology to Therapy
不断增长的肿瘤组织发展出以缺氧和酸中毒为特征的压力微环境。肿瘤细胞可以通过诱导主要由低氧诱导因子(HIF)介导的适应性转录变化,以及通过刺激维持正常细胞内pH的离子转运机制,来抵抗这些压力。另外,通过这些适应性应答,肿瘤细胞获得赋予其迁移,侵袭,转移和对治疗抗性的选择性优势的新特征。碳酸酐酶IX(CA IX)是一种与癌症相关的高活性碳酸酐酶同种型,与低氧(作为HIF的直接转录靶标)和酸中毒(与促进离子跨质膜运输的机制的一部分)相关联抵消酸性代谢产物的细胞内积累。 CA IX在人肿瘤中的表达模式反映了生理缺氧,遗传缺陷和/或致癌事件对HIF途径的激活。而且,CA IX不仅在pH调节中而且在细胞迁移和侵袭中都起着积极作用。因此,经常将其开发和/或研究为缺氧的内在标志物,预后指标和酶活性抑制剂或抗体的治疗靶标。相信这些靶向CA IX的治疗方法可以介导CA IX阳性细胞的选择性杀伤或使肿瘤细胞对常规治疗方式敏感。此外,CA IX特异性抗体和CA IX选择性抑制剂都可以用作成像工具,从而可以选择可能受益于CA IX定向疗法的患者。在了解CA IX调节和功能参与肿瘤进展以及CA IX结合药物开发方面的最新进展为治疗低氧性肿瘤提供了新的机会。
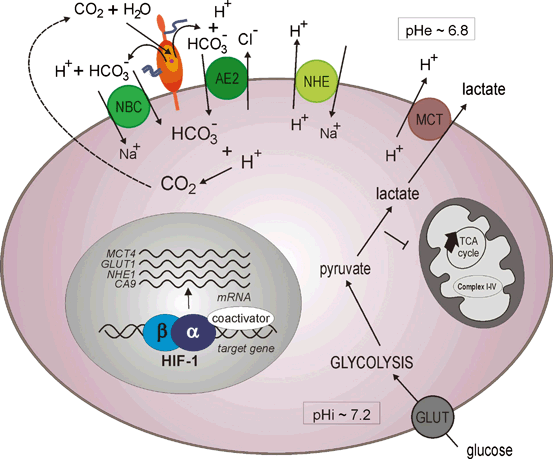
Carbonic Anhydrase IX: From Biology to Therapy
Growing tumor tissues develop a stressful microenvironment characterized by
hypoxia and acidosis. Tumor cells can survive these stresses via induction of
adaptive transcriptional changes mediated primarily by the hypoxia-inducible
factor (HIF), and via stimulation of ion transport machinery maintaining normal
intracellular pH. In addition, through these adaptive responses tumor cells
acquire new features endowing them with selective advantage in migration,
invasion, metastasis, and resistance to therapy. Carbonic anhydrase IX (CA IX),
a highly active cancer-related carbonic anhydrase isoform, is linked to both
hypoxia, as a direct transcriptional target of HIF, and acidosis, as a component
of mechanisms that facilitate ion transport across the plasma membrane and
thereby counteract the intracellular accumulation of acidic metabolic products.
Expression pattern of CA IX in human tumors reflects the activation of the HIF
pathway by physiologic hypoxia, genetic defects, and/or oncogenic events.
Moreover, CA IX plays an active role not only in pH regulation but also in cell
migration and invasion. Thus, it is often exploited and/or investigated as an
intrinsic marker of hypoxia, a prognostic indicator, and a therapeutic target
for antibodies or inhibitors of the enzyme activity. It is believed that these
CA IX-targeted therapeutic approaches can mediate the selective killing of CA
IX-positive cells or sensitize tumor cells to conventional treatment modalities.
In addition, both CA IX-specific antibodies and CA IX-selective inhibitors can
serve as imaging tools allowing for selection of patients potentially benefiting
from CA IX-directed therapy. Recent advances in understanding CA IX regulation
and functional involvement in tumor progression as well as development of CA
IX-binding drugs provide novel opportunities for treatment of hypoxic tumors.
Abbreviations
CA IX
carbonic anhydrase IX protein
CA9
carbonic anhydrase 9 gene/promoter
CAI
carbonic anhydrase inhibitor
Car
mouse CA gene
FIH
factor inhibiting HIF
GLUT
glucose transporter
HIF
hypoxia-inducible factor
HRE
hypoxia-response element
LDH
lactate dehydrogenase
MAPK
mitogen activated protein kinase
MCT
monocarboxylate transporter
NBC
Na + /bicarbonate co-transporter
NHE
Na + /H + exchanger
PDK
pyruvate dehydrogenase kinase
PG
proteoglycan-like domain
PHD
prolyl hydroxylase
pHe
extracellular pH
pHi
intracellular pH
PI3K
phosphatidyl inositol-3 kinase
RCC
renal cell carcinoma
VEGF
vascular endothelial growth factor
VHL
von Hippel Lindau
Carbonic Anhydrase IX: From Biology to Therapy | SpringerLink
https://link.springer.com/chapter/10.1007%2F978-1-4614-9167-5_6
Hypoxia and Cancer | SpringerLink
https://link.springer.com/book/10.1007/978-1-4614-9167-5
Frontiers | Characterization of the Tumor Microenvironment and Tumor–Stroma
Interaction by Non-invasive Preclinical Imaging | Oncology
https://www.frontiersin.org/articles/10.3389/fonc.2017.00003/full
Department of Medical Physics, Memorial Sloan Kettering Cancer Center, New York, NY, USA
Molecular Pathways: Emerging Pathways Mediating Growth, Invasion, and
Metastasis of Tumors Progressing in an Irradiated Microenvironment | Clinical
Cancer Research
https://clincancerres.aacrjournals.org/content/18/19/5196
Temperature Matters! And Why It Should Matter to Tumor Immunologists | Cancer
Immunology Research
https://cancerimmunolres.aacrjournals.org/content/1/4/210
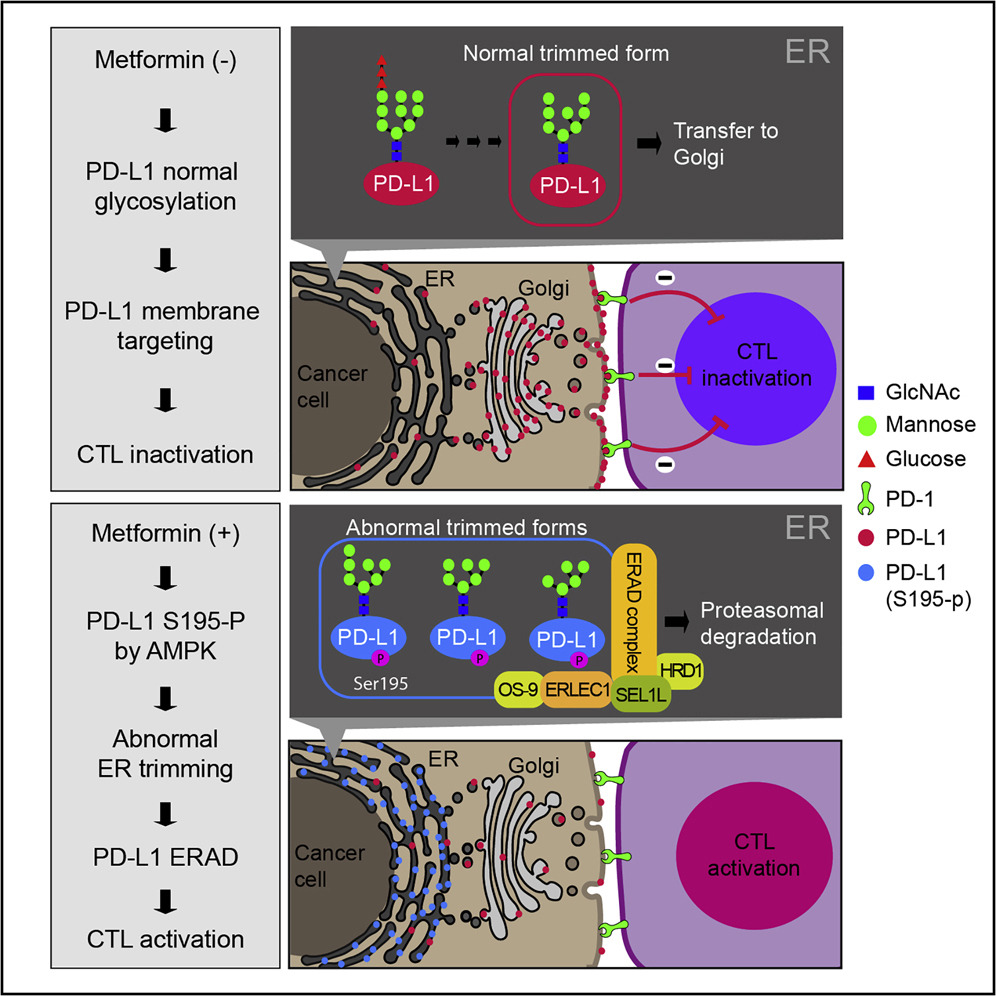
二甲双胍通过内质网相关降解PD-L1促进抗肿瘤免疫。
Metformin Promotes Antitumor Immunity via Endoplasmic-Reticulum-Associated
Degradation of PD-L1
University of Texas MD Anderson Cancer Center, Houston, TX 77030, USA
强调
•二甲双胍通过阻断PD-L1 / PD-1轴增强抗肿瘤CTL免疫力
•二甲双胍激活的AMPK在S195直接与PD-L1结合并磷酸化
•pS195诱导的PD-L1糖基化异常导致ERAD降解PD-L1
•二甲双胍和抗CTLA4联合治疗具有协同抗肿瘤作用
摘要
据报道,二甲双胍具有抗肿瘤活性并维持细胞毒性T淋巴细胞(CTL)高度免疫监测。但是,尚未完全了解二甲双胍在癌症免疫中的功能和详细机制。在这里,我们显示二甲双胍通过降低程序性死亡配体1(PD-L1)的稳定性和膜定位来增加CTL活性。此外,我们发现被二甲双胍激活的AMP激活的蛋白激酶(AMPK)直接磷酸化PD-L1的S195。
S195磷酸化诱导异常的PD-L1糖基化,导致其ER积累和与ER相关的蛋白质降解(ERAD)。一致地,二甲双胍治疗的乳腺癌患者的肿瘤组织在AMPK激活下表现出降低的PD-L1水平。通过二甲双胍阻断PD-L1的抑制信号可增强针对癌细胞的CTL活性。我们的发现确定了通过ERAD途径表达PD-L1的新调节机制,并表明二甲双胍-CTLA4阻断剂组合具有提高免疫疗法疗效的潜力。
Metformin Promotes Antitumor Immunity via Endoplasmic-Reticulum-Associated
Degradation of PD-L1 - ScienceDirect
https://www.sciencedirect.com/science/article/pii/S1097276518305999#!
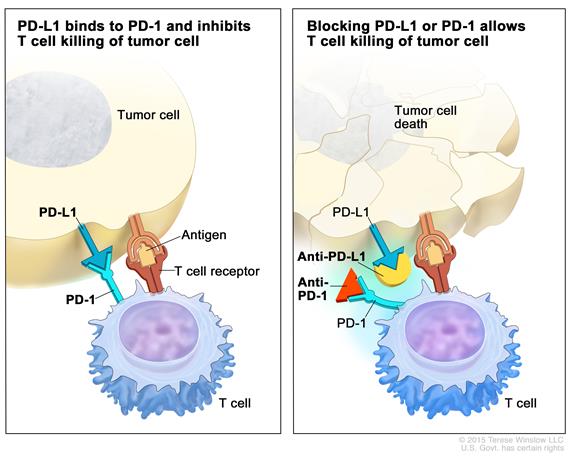
PD-1/PD-L1抗体-抗肿瘤原理
肿瘤微环境影像
低氧
肿瘤缺氧已经通过非侵入性成像,并通过低氧细胞中积累的缺氧标记物直接通过PET,电子顺磁共振(EPR)或19F
MRS可视化(65、248、258–266)。将特定的缺氧标记物递送至血管少的区域(通常与缺氧有关),可能会影响累积的缺氧标记物的强度(246、267)。由于组织中慢性或急性缺氧的发展与氧气的血管输送有关,因此已经开发了几种基于与肿瘤缺氧相关的血管特征的间接MRI方法,例如BOLD,TOLD或DCE-MRI,以识别缺氧区域或缺氧区域。肿瘤的缺氧变化(64、246、268–271)。组织氧张力已通过19F
MRI氧测定法使用全氟化碳作图;与任何外源示踪剂一样,这些测量值依赖于血管输送,因此可能偏向灌注良好的肿瘤区域(271)。尽管碳酸酐酶-IX(CA-IX)被认为是肿瘤中的内在低氧标志物,但通过免疫组织化学测量的CA-IX表达在某些研究中与低氧相关,而在其他研究中则没有(260)。然而,正在尝试通过PET(272),NIRF(273)和SPECT(274)对体内CA-IX表达进行成像。
糖酵解和乳酸
通常在葡萄糖转运蛋白(GLUT-1,GLUT-3;在癌症中通常过表达)摄取18F-FDG之后,己糖激酶II(256, 275)。尽管13C
MRS相当不敏感,但已在临床前应用于评估糖酵解和下游代谢物的13C标记(275-277)。 13C
MRS的检测灵敏度可以通过磁化转移技术或间接反向检测显着提高(276、277)。
13C标记底物的超极化可将检测灵敏度提高多达10,000倍,但需要注意的是,超极化作用是短暂的,目前仅限于几种底物,包括葡萄糖(64、275、276、278、279)。压缩感测可以进一步提高超极化(HP)13C
MRSI(280)的采集速度和空间分辨率。可以通过HP 13C
MRSI快速评估来自前体(例如13C标记的丙酮酸或葡萄糖)的乳酸盐产量,并将其定位在本地(278,279)。已通过1H
MRS和MRSI评估了肿瘤乳酸的稳态水平,使用光谱编辑方法来抑制高脂质信号重叠的乳酸(64,275,281-285)。
pH值
非侵入性地测量肿瘤组织的pH值具有挑战性,并且已经并且正在开发各种方法来临床前测量细胞外和/或细胞内pH(pHe或pHi)(64、286)。
肿瘤pHe和pHi分布可通过使用3-氨基丙基膦酸酯(287,288)的31P MRS / MRSI获得。但是,不敏感的31P
MRSI限制了其空间分辨率,并限制了其广泛的适用性。因此,已开发出1H MRSI
pHe标记以提高检测灵敏度(288-291)。为了缩短采集时间并进一步提高灵敏度,并有可能进行临床翻译,已提出将注射的碳酸氢盐的HP 13C
MRSI用于pH成像,并根据信号强度比计算pH(主要是pHi,尽管不能区分pHi和pHe)。超极化的H13CO-3至13CO2(292,293)。但是,该反应取决于组织中的CA-IX活性,因此,必须分别对每种组织类型进行校准,从而限制了其适用性(294)。化学交换饱和转移(CEST)MRI可检测酰胺质子与周围水分子之间的pH依赖化学交换(291、295)。在acidoCEST中,具有两个酰胺质子的CEST试剂的CEST效果比的pH依赖性(产生两个CEST效果)用于测量pHe(295-297)。通过acidoCEST测量pH值的挑战包括灵敏度低,需要优化实验参数(295),并且可能并不总是认为CEST效果仅对所选CEST试剂的酰胺质子可见,并且仅受pH影响(
291)。
最近,放射性标记的pH(低)插入肽的细胞膜插入的pH依赖性已被用于临床前用PET成像肿瘤pH(在细胞内/细胞外界面)(298-301)。
其他评估体内pH的非侵入性成像方式包括使用pH敏感染料(302-304)或pH敏感报告基因(305)的光学成像,使用pH敏感纳米探针的比例PAI(306,307),使用具有pH敏感性(和浓度依赖性)弛豫性的CA,难以在体内测量CA浓度(291)和EPR光谱(308,309)。
此外,正在开发将pH敏感的探针作为治疗诊断剂,将治疗与诊断和监测功能结合在一起(310-314)。值得注意的是,所有外源pH标记物都依赖于递送,并且可能无法在临床上翻译,这给pHe
/ pHi成像带来了更多挑战.
Frontiers | Characterization of the Tumor Microenvironment and Tumor–Stroma
Interaction by Non-invasive Preclinical Imaging | Oncology
https://www.frontiersin.org/articles/10.3389/fonc.2017.00003/full
利用“Hif成瘾”进行癌症治疗
Exploiting “Hif Addiction” For Cancer Therapy
来自于缺氧和癌症
瘤内缺氧是实体肿瘤的一个共同和统一的特征,它与细胞代谢改变、侵袭性和转移性表型以及对放疗和化疗的耐药性有关。缺氧诱导因子-1
(HIF-1)是一种转录因子,在细胞对缺氧和肿瘤进展的反应中起关键作用。HIF-1的发现为缺氧肿瘤微环境提供了一个分子靶点,为开发新的癌症治疗方法提供了可能。然而,HIF-1在人类癌症中的表达具有局限性和异质性,这与单药HIF-1抑制剂的临床疗效存在强烈争议,并为联合治疗打开了大门。治疗诱导的低氧肿瘤微环境,以及随后HIF-1依赖通路的激活,可能产生一种“HIF成瘾”,这将是充分利用HIF-1抑制剂的最佳环境。有趣的是,针对肿瘤血管系统的治疗已被证明在某些情况下会增加瘤内缺氧,而缺氧被认为介导了抗血管生成治疗的几种耐药机制,这为HIF-1抑制剂联合治疗提供了理论基础。在这一章中,我们讨论了利用已知的HIF抑制剂来提高临床疗效的治疗性“HIF成瘾”的潜力,同时牢记患者的选择是至关重要的。
关键字
缺氧HIF-1肿瘤微环境抗血管生成剂血管阻断剂联合治疗肿瘤
Exploiting “Hif Addiction” For Cancer Therapy | SpringerLink
https://link.springer.com/chapter/10.1007/978-1-4614-9167-5_14
.jpg)
Inhibiting Hypoxia-Inducible Factor 1 for Cancer Therapy | Molecular Cancer
Research
https://mcr.aacrjournals.org/content/4/9/601
术中应用吖啶橙光动力术(iPDS)治疗骨骼肌肉瘤
Intraoperative Photodynamic Surgery (iPDS) with Acridine Orange for Musculoskeletal Sarcomas
我们最近建立了一种新的吖啶橙acridine orange (AO) (AOT)保肢方式,试图开发一种对正常组织损伤最小、局部复发风险低的微创保肢手术。治疗方式包括术中光动力手术(iPDS)和光动力治疗(iPDT),术后应用AO放射动力治疗(RDT)治疗高度恶性肌肉骨骼肉瘤。临床结果表明,该治疗具有较低的局部复发风险,其风险与常规广泛性切除几乎相同,与广泛性切除相比,具有更好的肢体功能。
在这篇综述中,我们介绍了在肉瘤中AO选择性积累的详细机制,这与癌症特异性糖酵解诱导的肿瘤细胞的酸性环境和溶酶体酸性有关,但不涉及确定的三羧酸(TCA)周期(Warburg效应)
)。我们还描述了AOT的临床用途以及使用局部AO进行术中光动力手术(iPDS)的过程。
简介与背景
对于每个医学领域的所有肿瘤外科医师来说,在手术切除过程中准确地可视化肿瘤都是梦想。这将使得容易且完全去除肿瘤块而不会过度破坏正常组织。这将导致器官或组织的良好功能。然而,尽管有各种各样的报道报道了使用各种荧光染料来实现这一目的[1-5],但是还没有设计出这种理想的方法。本文将介绍一种可以帮助外科医生实现梦想的理想药物:cr啶橙(AO)。
AO不是新合成的产品。它于19世纪末从煤焦油中首次提取,是一种弱碱性染料,可用于染色衣服或染色微生物。如先前报道,AO具有许多独特的生物学活性,例如抗肿瘤活性,光敏活性,pH检测活性,荧光发射,精子,细菌,病毒,寄生虫和真菌中的染色活性[6-14]。
AO还具有变色的独特特征,在蓝光激发后,它会从单体形式发出绿色荧光,而从二聚体形式发出橙色荧光[7]。
由于AO具有简单的化学结构和非常低的分子量(MW
265)(图1),因此它具有通过被动扩散通过质膜快速流入活细胞的细胞质并结合多种RNA的能力。和溶酶体[15]。
AO是一种弱碱性染料,在酸性条件下尤其容易积累。最近有报道称,大多数癌症具有酸性微环境(酸性胞外液:pH
6.5-7.0)和大量大型溶酶体,溶酶体具有强酸性囊泡液(pH
3.0-5.0)[16]。我们发现高恶性肉瘤比良性肿瘤和正常软组织[17]有更多的酸性微环境。因此,我们可以很容易地期望AO选择性地在肉瘤中积累,并在荧光[18]的手术中,在光动力诊断(PDD)中检测肿瘤定位。如果是临床应用,我们可以通过荧光手术显微镜检测肿瘤组织的荧光(荧光显示效果),只精确切除肿瘤组织。它对正常组织如主要神经、血管、肌肉、骨骼和关节等造成的损害最小。最好将这种治疗称为光动力手术(PDS)。我们还证明了AO在可见光或低剂量x射线照射下对肉瘤细胞在体内外都有选择性的杀细胞作用。临床上可用于光动力治疗(PDT)[16-21]或放射动力治疗(RDT)[22-23]。
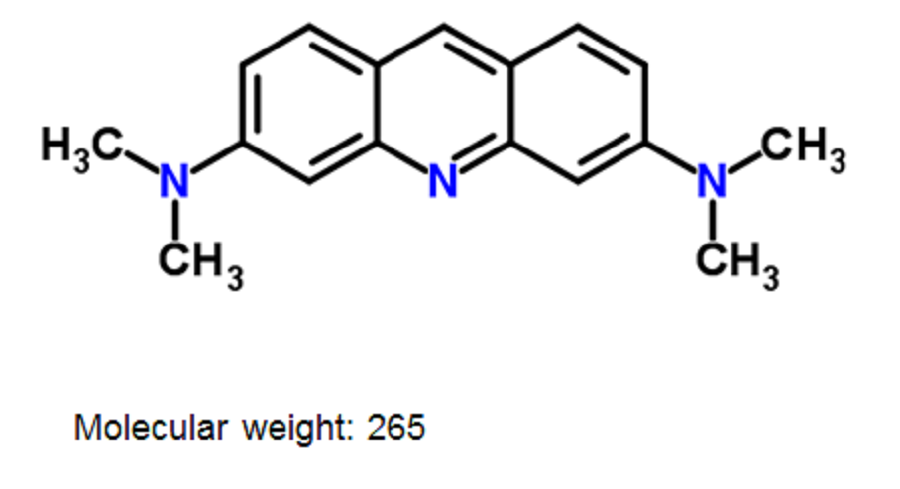
图1:吖啶橙(AO)的化学结构
根据基础研究的数据,我们在肌肉骨骼肉瘤患者局部给予AO之后,采用了AO治疗(AOT)支持的复位手术。这种光疗方式包括三个主要步骤:1)术中PDD(iPDD)之后立即进行术中PDS(iPDS);
2)病灶内或囊外边缘肿瘤切除术后的术中PDT(iPDT); 3)手术后立即进行RDT
(术后RDT)。与通常引起严重肢体功能障碍的常规宽切除手术的结果相比,通过这种方法,我们已经获得了良好的局部控制率和明显更好的肢体功能[24-31]。
在本文中,我们将重点放在iPDD和iPDS上,并使用荧光外科显微镜对AO进行局部给药,展示了基础研究的结果以及AOT在临床上的应用程序的细节。
基础研究
AO在活细胞中的可持续性与凋亡或固定细胞
在用乙醇固定的细胞进行蓝光激发(492 nm)之后,AO使用特殊的磷酸盐进行两步处理,从而将核DNA染色为绿色荧光(533
nm),并将胞质和核仁RNA染色为红色荧光(656
nm)。缓冲溶液[32-33](图2、3)。另一方面,AO将培养基中活细胞的细胞质和核仁RNA染成绿色,将囊泡染成红色(图4)[15]。
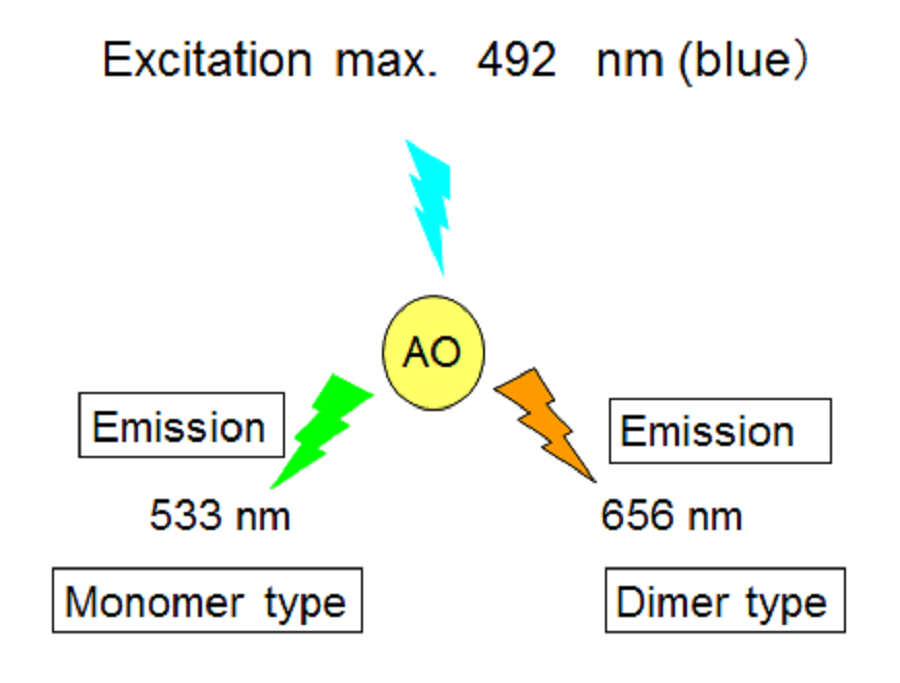
图2:AO的激发和发射(色盲)
AO被492 nm(最大)的蓝光激发,从单体类型发出绿色荧光(最大533 nm),从调光器类型发出红色荧光(最大565 nm)。
学习发音
AO被492 nm(最大)的蓝光激发,从单体类型发出绿色荧光(最大533 nm),从二聚体类型发出红色荧光(最大565 nm)。
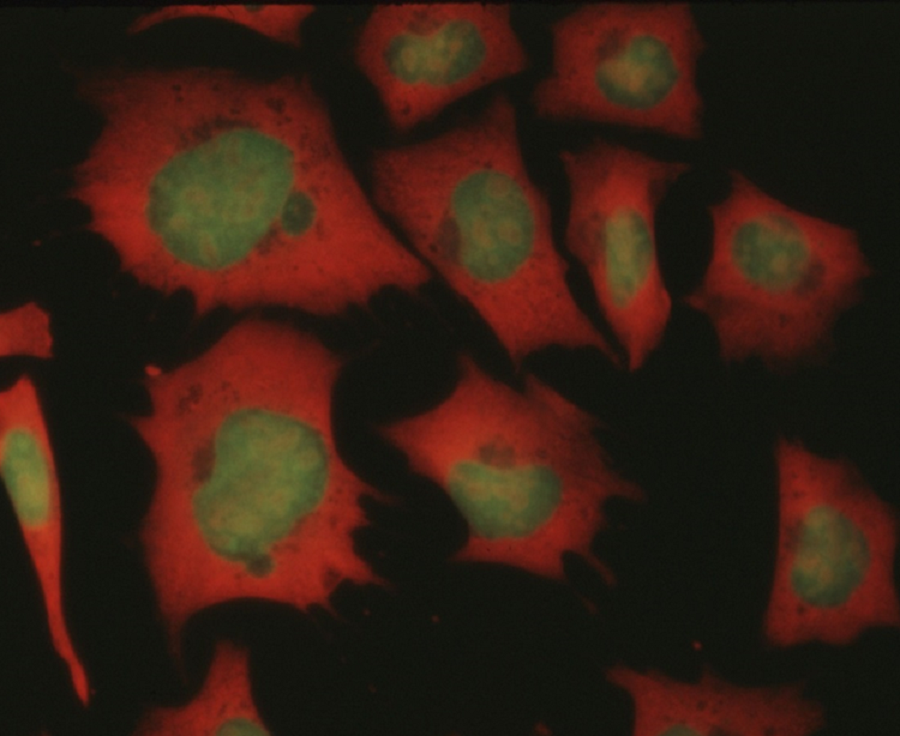
图3:使用荧光显微镜在乙醇固定后用AO染色的小鼠骨肉瘤细胞(MOS)的荧光图
从胞质和核仁中,与RNA紧密结合的AO发出红色荧光,而从细胞核稀疏结合的AO发出绿色荧光。 AO与核酸的结合机制是插入其链中。
从胞质和核仁中,与RNA紧密结合的AO发出红色荧光,而从细胞核稀疏结合的AO发出绿色荧光。 AO与核酸的结合机制是插入其链中。
活体小鼠骨肉瘤细胞(MOS)的荧光激发后暴露于AO的荧光图
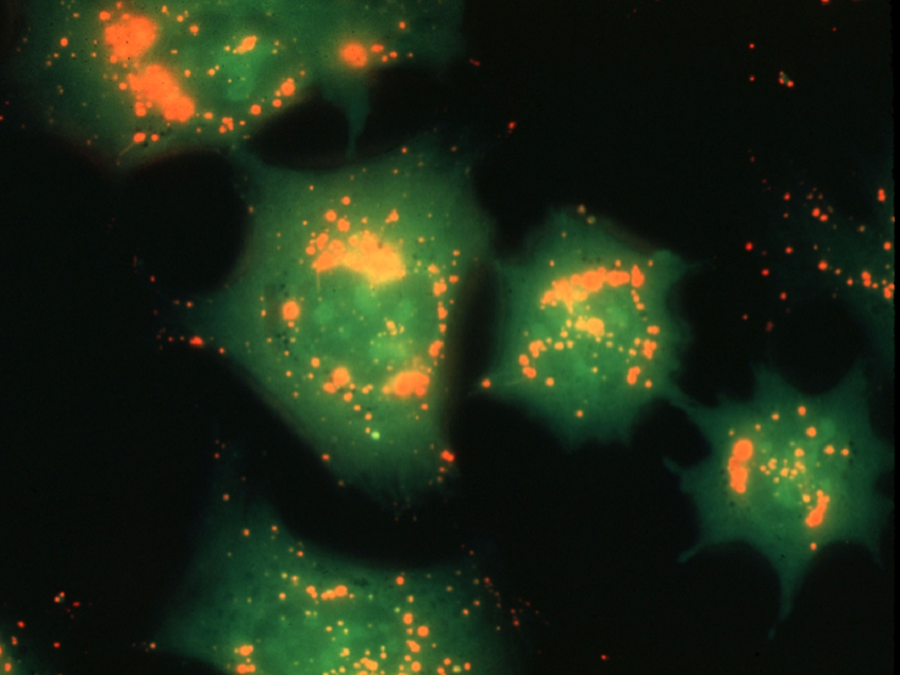
图4:使用荧光显微镜激发后暴露于AO的活体小鼠骨肉瘤细胞(MOS)的荧光图
AO与细胞质和核仁RNA结合时发出绿色荧光,而酸性囊泡(如溶酶体)则发出红色荧光。
全尺寸下载
AO与细胞质和核仁RNA结合时发出绿色荧光,而酸性囊泡(如溶酶体)发出红色荧光。完整活细胞的核DNA不被AO染色,而凋亡细胞的核DNA被染色(图5、6)。
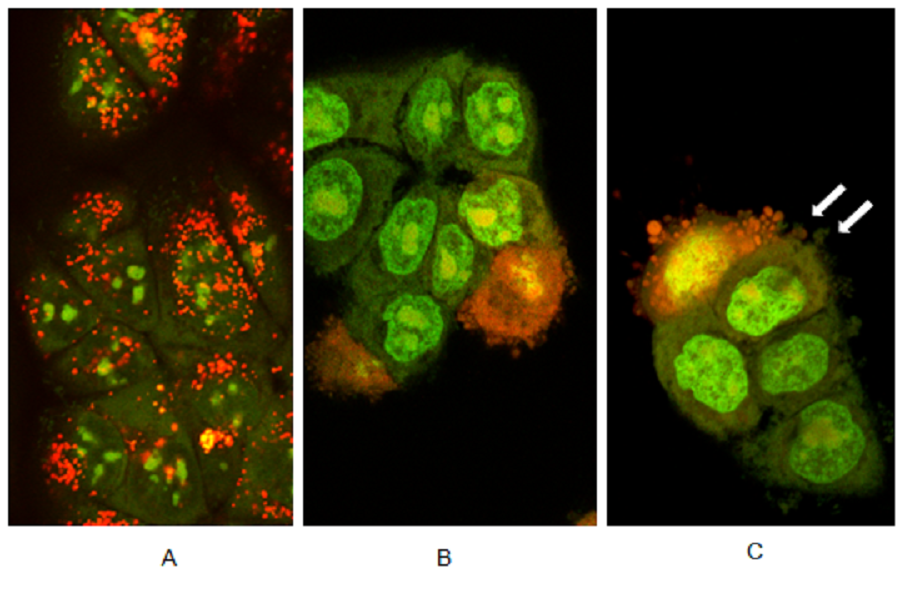
图5:使用共聚焦激光荧光显微镜在蓝光激发后暴露于AO的人胃癌细胞(MK28)的扫描荧光显微镜图
A:完整的活细胞,B:早期和晚期凋亡细胞,C:凋亡细胞的气泡和微粒(箭头)
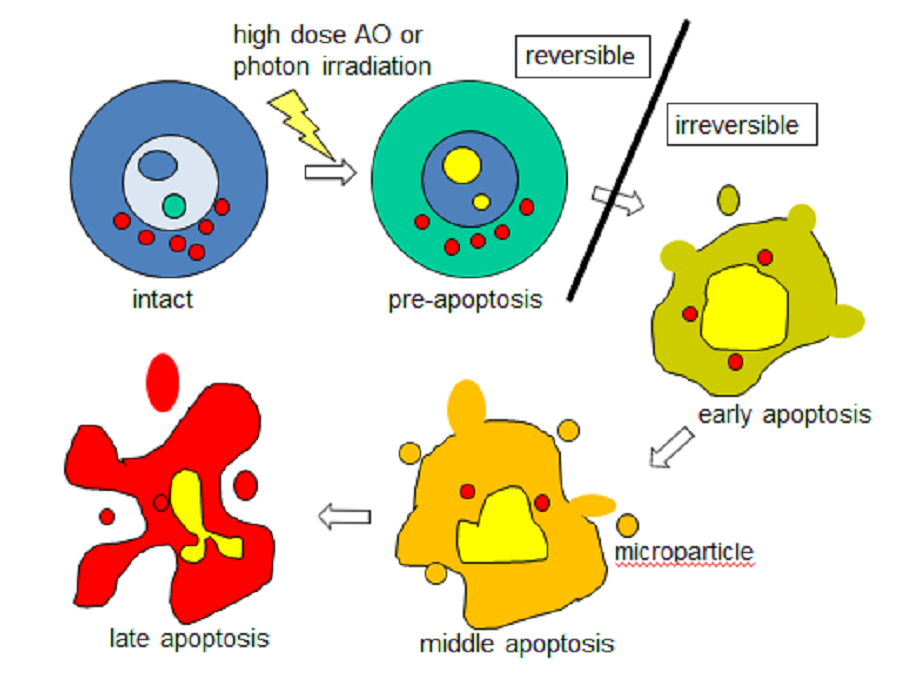
图6:从完整的活细胞到凋亡细胞的AO染色性的顺序变化(见文本)
因此,固定细胞和培养细胞之间的AO染色性完全不同。固定和培养细胞的不同AO染色能力使许多人困惑了很长时间。由于AO是一种弱碱性染料,因此会通过质子化而被电离。
AO比碱性溶液更易溶于酸性溶液(如HCl)(AO粉不溶于浓NaOH溶液)。与中性或碱性环境相比,AO在组织的酸性环境中更容易积聚。在固定细胞中,AO通过插入到RNA的单链的酸性部分比结合到DNA的双链更紧密地结合[6-7,32-35]。因此,RNA中AO的二聚体类型(致密AO)发出红色荧光,而DNA中AO的单体类型(稀疏AO)发出绿色荧光。这种现象是所谓的“变色”。另一方面,在完整的活细胞中,AO通过插入细胞质中转移,微小,核糖体和信使RNA的酸性部分而稀疏地结合,在激发蓝光后发出绿色荧光。但是AO不与核DNA的双链结合。
AO显示出在酸性囊泡中的密集积累,其中大多数是溶酶体,发出红色荧光。完整的活细胞具有完整的生物膜,包括细胞质膜,核膜和溶酶体膜。这是固定细胞,凋亡细胞和完整细胞之间AO的不同染色性的最重要原因。由于缺少特殊的转运蛋白或离子通道,电离的AO无法通过此类生物膜,而非电离的AO则可以在这些膜上被动扩散[36]。固定细胞或凋亡和死细胞失去了膜屏障系统。因此,AO与所有酸性部分结合,而与生物质子分布无关。这些细胞的溶酶体也通过受损的膜失去了酸性体液。因此,AO不会在这些细胞的溶酶体中积累。在中性pH(7.4)培养基中培养的活细胞中,未电离的AO通过扩散通过细胞质膜迅速被动地进入细胞质,该细胞膜含有大量的脂肪酸和胆固醇,而AO显示出强大的结合亲和力。
AO通过插入快速结合到细胞质中的转移RNA和微小RNA,以及核仁中的核糖体RNA和信使RNA。
AO还基于其对质子的亲和力在溶酶体的酸性腔液中蓄积。由于AO结合RNA发出绿色荧光,因此AO稀疏地以单体形式结合到RNA。溶酶体中的AO由于其强酸性而被质子化而离子化良好。出于与上述相同的原因,电离的AO无法穿过溶酶体膜进入细胞质。在高质子浓度下,电离的AO浓度增加,电离的AO形成二聚体,这导致AO在蓝光激发后发出红色荧光[36]。我们已经从形态上证实了AO不会在其他细胞器中积累,例如线粒体,高尔基体或内质网(ER)(图7)[15]。
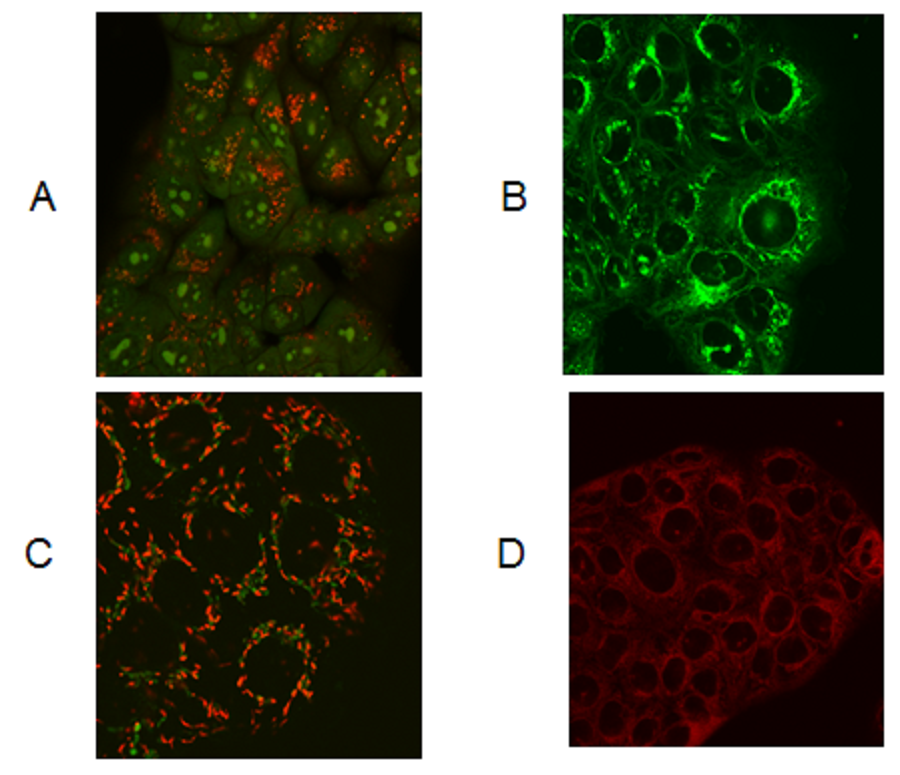
图7:人胃癌细胞的扫描荧光显微镜图
人胃癌细胞(MK28)的扫描荧光显微图:(A)暴露于AO,(B)高尔基(BODIPY®FL
C5-神经酰胺),(C)线粒体(JC-1)和(D)ER(ER追踪器红色)
AO不与完整活细胞中的核DNA结合,而与细胞凋亡或死细胞中的核DNA结合(图5、6)。这就是为什么AO通常用于检测细胞凋亡的原因[37-38]。结论是完整活细胞中AO的结合靶点是各种RNA和酸性囊泡,其中大多数是溶酶体。
体外和体内小鼠骨肉瘤细胞中AO的选择性积累
我们使用小鼠骨肉瘤细胞(MOS细胞系)进行的基础研究结果表明,AO以二聚体形式与溶酶体和其他酸性囊泡紧密结合,包括内体,吞噬体,分泌颗粒等,在蓝光激发后发出橙色荧光。
AO还仅以单体形式稀疏地结合到细胞质中的RNA(转移RNA和微小RNA)和核仁(核糖体RNA信使RNA),发出绿色荧光(图4)。
在使用小鼠骨肉瘤模型进行的一项体内研究中,在腹膜内(10 mg / kg)或静脉内注射(1 mg /
kg)AO,然后激发蓝光,而正常肌肉后两个小时,肿瘤发出了强烈的绿色荧光脂肪组织细胞不发出任何这种荧光。因此,在配备高分辨率CCD摄像头的荧光手术显微镜下,荧光可以清晰地看到肿瘤(荧光可视化效果)(图8)[18,20-21]。
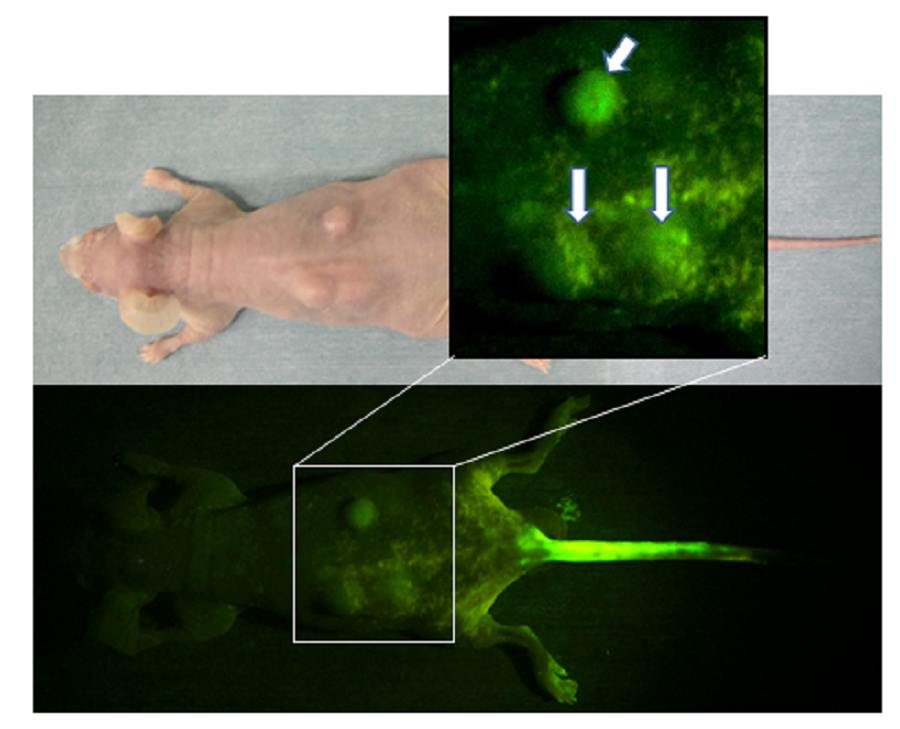
图8:在通过尾静脉注射AO后两个小时,在蓝光激发后,在裸鼠的背部皮下接种了小鼠骨肉瘤的宏观荧光图(见正文)
肿瘤发出绿色荧光(箭头)。尾静脉的注射部位也发出绿色荧光。
全尺寸下载
即使很小的病变,例如直径小于1毫米的小鼠骨肉瘤的多发性肺转移,也可以通过发射的荧光轻松检测到(图9)。
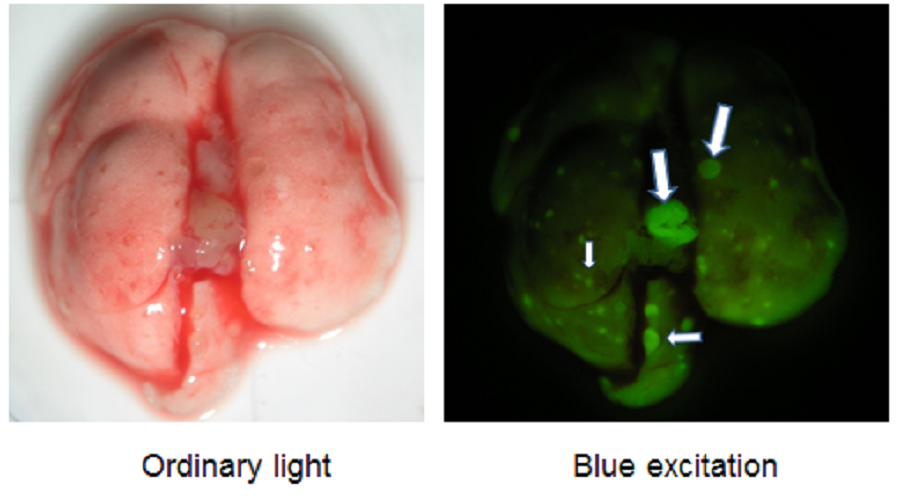
图9:与图8相同的裸鼠切除的小鼠骨肉瘤的肺转移灶的宏观荧光图(见正文)
多个转移性病变,甚至很小的病变,都会发出亮绿色的荧光(箭头)。
我们调查了小鼠注射骨肉瘤和肌肉后AO荧光强度的顺序变化。
AO迅速流入肿瘤和肌肉。然而,肌肉在两个小时内迅速排除了AO。另一方面,即使在两个小时之后,肿瘤也更缓慢地排除了AO,染料仍保留在肿瘤中。因此,AO在肿瘤中的保留时间要长于肌肉中的保留时间[18,21]。
局部给药后人肌肉骨骼肉瘤中AO的选择性积累
在暴露于AO溶液中并随后激发蓝光之后,没有肿瘤囊的手术切除和切割的肿瘤标本仅从肿瘤组织而不是周围的正常组织发出强烈的绿色荧光。我们证实,大多数人类恶性骨和软组织肿瘤对AO敏感[17]。
使用新鲜和切开的肉瘤标本,我们调查了肿瘤酸度和AO荧光强度之间的关系。使用针式pH计测量的切除组织的平均pH值在35个肉瘤中为6.78,在27个良性肿瘤中为7.16,在正常肌肉中为7.26,在正常脂肪组织中为7.43。
AO的荧光强度以依赖于这些组织的酸性的方式增加。酸性恶性肿瘤显示较强的AO荧光。这些结果表明,选择性AO与肌肉骨骼肉瘤的结合是由于肉瘤细胞的酸性细胞外液和酸性溶酶体[17]。因此,在荧光刮刀显微镜下,在刮除肿瘤后的手术期间,用AO染色可用于视觉检测残留的肿瘤组织。如iPDS
[17-18],这使得外科医生可以轻松地完全切除肿瘤组织,而对正常组织的损害却最小。
肉瘤中选择性AO积累的机制
尽管在体外研究中已显示AO可染色所有活细胞,不仅包括肉瘤细胞,而且还可染色正常细胞,但在全身性AO给药后两小时,AO仅在肉瘤中蓄积并发出蓝光激发绿色荧光。我们还在一项体内研究中显示,AO在所有细胞中均积累,但正常细胞比肉瘤细胞更快地排斥AO。但是,我们没有任何证据表明正常细胞(成纤维细胞系)在体外能更快地排除AO,尽管成纤维细胞中AO-PDT的AO荧光强度和杀细胞作用比肉瘤细胞弱。这种现象表明,在体外和体内条件下,正常细胞和肉瘤细胞中AO积累存在一些差异。
最近的许多研究表明:1)癌细胞在缺氧或沃堡效应下通过主动糖酵解产生大量质子(H +)[39-40]; 2)质子通过液泡型H +
-ATPase(V-ATPase)储存在溶酶体和其他酸性囊泡中,导致溶酶体和其他酸性囊泡在癌细胞中的酸性比在正常细胞中更高[41-42] ;
3)由于NHE(Na-H
+交换子),V-ATPase和MCT(单羧酸盐转运蛋白)从细胞质空间排除的质子数量比正常细胞多,因此癌细胞周围的细胞外液也更酸性。碳酸酐酶9产生的质子数量更多[43]。由于AO在酸性环境中蓄积,具有大量酸性囊泡的肉瘤细胞无法轻易排除AO,而具有非酸性环境和弱酸性溶酶体的正常细胞可以迅速排除AO。已经阐明,巴氟霉素对V-ATPase活性的抑制导致溶酶体中AO积累的减少[44]。这表明AO以酸度依赖性方式在溶酶体中积累。
另一方面,pH分配理论[45]假设弱碱性药物(例如AO)或许多抗癌药物(例如阿霉素)会积聚在人体的酸性液体中,并通过质子化作用被电离(图10)。
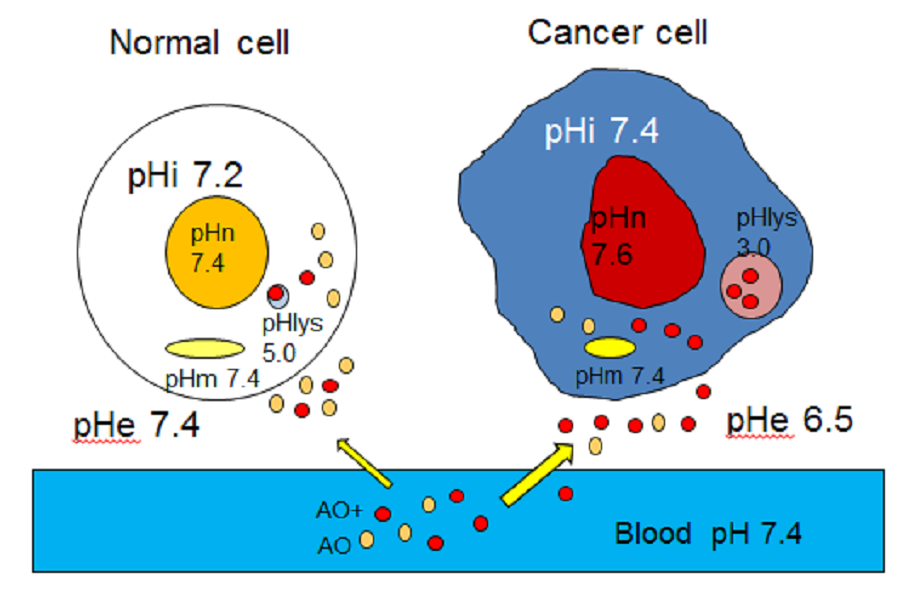
图10:通过pH分配理论推测的AO积累机制在正常和体内癌细胞中
非电离的AO(黄色)首先在酸性细胞外液中积累,其中一些通过质子化变成电离(红色)。电离的AO不能进入细胞质,而非电离的AO则很容易通过扩散进入细胞。细胞质中非电离的AO也可以通过扩散而积累在溶酶体中,这取决于溶酶体中的酸度和电离水平。由于膜屏障,电离的AO无法扩散回细胞质。
非电离的AO(黄色)首先在酸性细胞外液中积累,其中一些通过质子化变成电离(红色)。电离的AO不能进入细胞质,而非电离的AO则很容易通过扩散进入细胞。细胞质中非电离的AO也可以通过扩散积累在溶酶体中,这取决于溶酶体中的酸度和电离水平。由于膜屏障,电离的AO无法扩散回细胞质。
因此,我们解释肉瘤细胞中AO积累机制的假设如下。通过乳酸的主动糖酵解产生大量氢离子(质子),这些氢离子通过V-ATPase储存在溶酶体或酸性囊泡中。由于各种质子转运子质子的挤出,癌细胞周围的细胞外液也是酸性的。局部或全身给药的AO首先在酸性细胞外液中蓄积,然后被动扩散到胞质空间,然后基于低pH(高酸度)在溶酶体中蓄积。细胞质AO也通过插入稀疏地与RNA结合,这是与溶酶体结合的另一种类型(图11)。
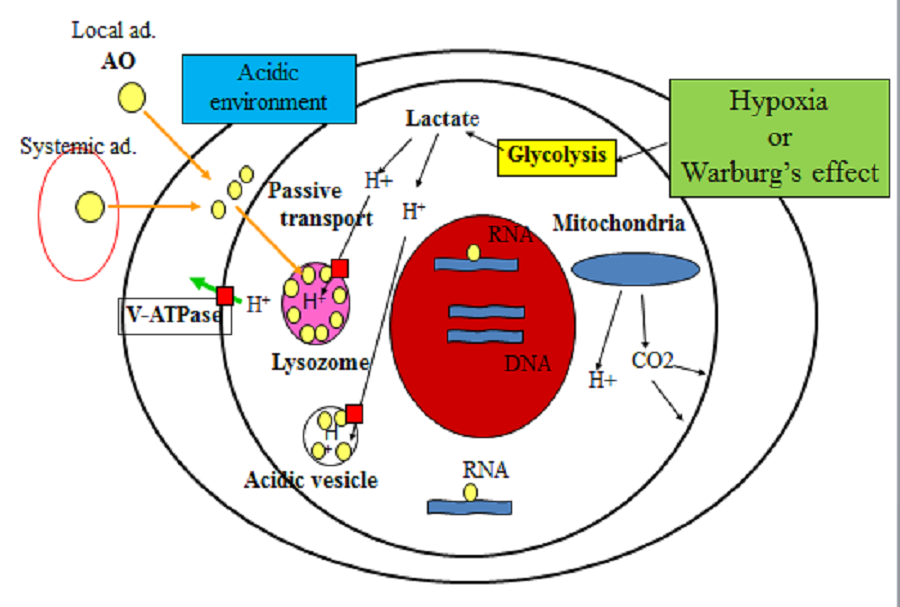
图11:AO在细胞外空间,细胞质,RNA和溶酶体中的积累(见正文)
全尺寸下载
AO-PDT和AO-RDT
我们还发现,在体外和体内蓝光照射(AO-PDT)后,AO对小鼠骨肉瘤细胞均具有很强的杀细胞作用。在体外,骨肉瘤细胞在暴露于1μg/ ml
AO之后的24小时内迅速死亡,然后以10,000的发光强度(与lux单位相同)光照10分钟,并且所有细胞在72小时内死亡。甚至在多重耐药性骨肉瘤细胞中也注意到了这种杀细胞作用。在使用小鼠骨肉瘤模型进行的体内研究中,通过以10
mg /
kg的剂量向腹膜内注射AO,然后对肿瘤进行光照,可以显着抑制肿瘤的生长。这一结果表明,AO在肌肉骨骼肉瘤患者中进行光动力治疗具有潜在的作用[20-22]。
此外,我们发现,小鼠骨肉瘤暴露于AO后5
Gy的低剂量X射线辐射在体外和体内均具有与AO-PDT相同的强杀细胞作用[22]。爱荷华大学的一个研究小组在2006年独立地证明了这种AO的辐射效应[23]。他们表明,AO暴露后在3
Gy处进行X射线辐照显着提高了耐放射线软骨肉瘤细胞的细胞死亡,但并未提高放射敏感性细胞的细胞死亡。因此,此作用可能是通过与AO-PDT不同的机制介导的。但是,AO无疑增强了辐射诱导的癌细胞杀伤。我们基于这种现象放射动力疗法(RDT)命名了治疗方法。
X射线辐照具有比光束到达人体更深的区域的优点,尽管它对正常组织的伤害更大。 AO以每30分钟5毫米的速度迅速侵入较深的组织。
图12中的示意图显示了AO-PDT的溶酶体机制。
AO以酸性依赖性方式积累在癌细胞的溶酶体中。借助蓝光照明的光子能量,AO被能量转移激发。激发的AO激活溶酶体中的氧气,同时发出荧光,成为稳定的AO类型。活性氧(单氧)将溶酶体膜的脂肪酸氧化,导致各种溶酶体酶(如蛋白酶,脂肪酶和核酸酶)渗入胞质空间。据报道,
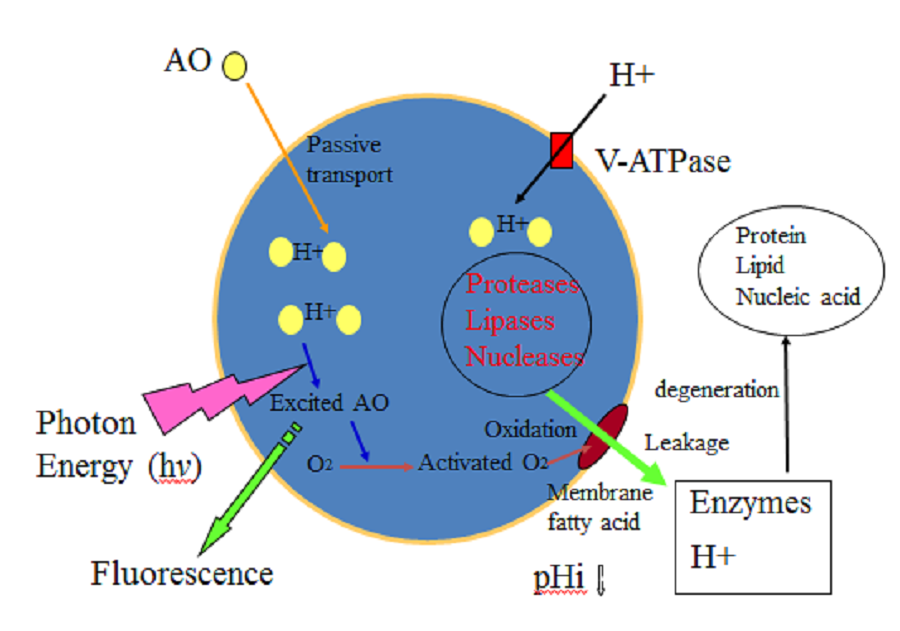
图12:AO-PDT破坏溶酶体的过程(见正文)
全尺寸下载
大量的质子也泄漏到胞质空间,然后变成酸性。这些酶在酸性胞质条件下消化重要的细胞成分。此类溶酶体应激激活caspase,从而诱导细胞凋亡,并伴有细胞肿胀,气泡形成和释放微粒(包括外泌体),最终导致细胞破碎(图5、6)。
AOT的临床应用
肌肉骨骼肉瘤患者的AOT程序(图13A-13E)。
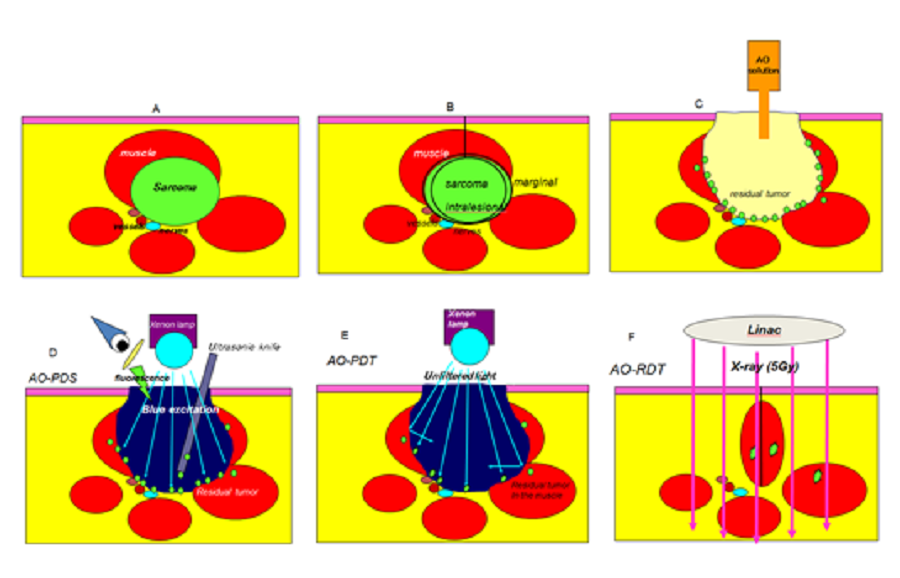
图13:用于临床的AO治疗程序(见正文)
A)靠近主要血管和神经的肌肉肉瘤; B)具有边缘/病变内边缘的肿瘤切除; C)AO溶液的局部给药D)在荧光显微镜下进行额外的肿瘤切除;
(光动力外科:AO-PDS)E)光动力疗法(AO-PDT); F)放射动力疗法(AO-RDT)
全尺寸下载
1)宏观刮除肿瘤(图13A,13B)
如果肉瘤位于靠近主要神经,血管,肌肉或骨骼和关节的肌肉或骨骼中,则进行部分刮除术,对肿瘤进行肿瘤内切除或边缘切除(囊外切除)。进行这些程序的目的是使对与肿瘤紧密接触的完整肌肉和骨骼或对主要神经和血管的损害最小化,以便在手术后获得良好的肢体功能。
2)AO局部给药的术中光动力手术(iPDS)(图13C)
另外,使用荧光手术显微镜用超声波手术刀(日本东京的奥林巴斯公司(Olympus Co.Ltd。,Tokyo,Japan))进行刮除术。将1μg/ ml
AO溶液(SIGMA-ALDRICH
CO,美国密苏里州圣路易斯)局部给药(浸泡)五分钟后,用盐水冲洗掉过量的AO溶液,然后用蓝光激发肿瘤的荧光可视化。德国Oberkochen的卡尔蔡司有限公司制造的手术显微镜专门配备了干涉滤光片(466.5
nm),用于选择氙气灯发出的蓝光;以及吸收滤光片(> 520 nm),用于观察绿色。
AO的荧光(图14A)。重复iPDS,直到残留肿瘤组织中的绿色荧光完全消失为止(图14B,14C)。
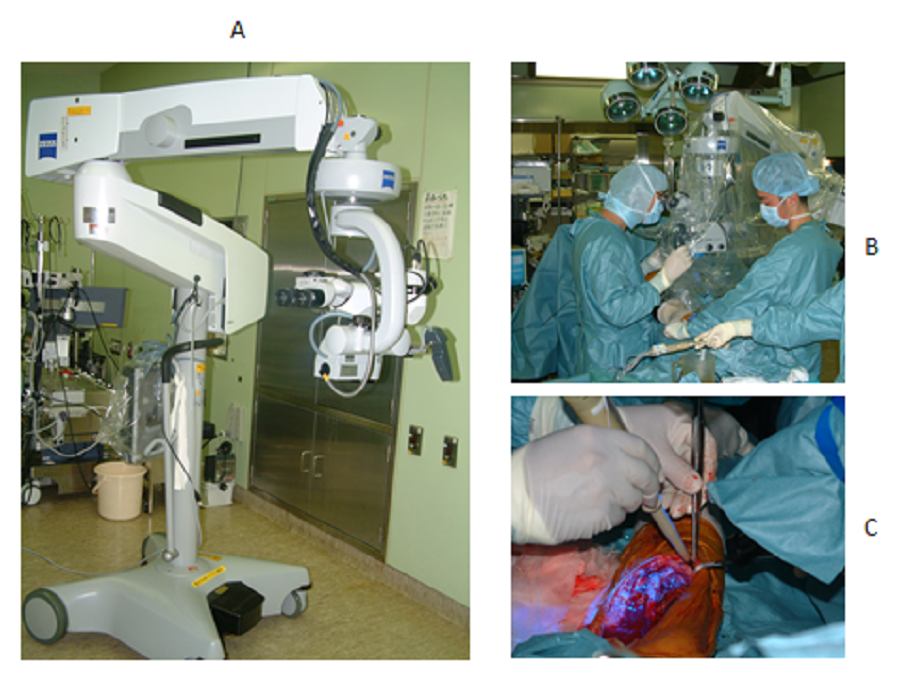
图14:荧光手术显微镜(A)和手术期间PDS的场景(B和C)
全尺寸下载
在此过程中,我们通过浸泡局部应用AO,以在宏观肿瘤切除后暴露残留的肿瘤碎片。如果在切除前对包封的肿瘤进行相同的操作,AO将不会有效地积聚在肿瘤组织中,包括在间质基质或细胞中,因为肿瘤囊在非酸性正常细胞和酸性癌细胞外液之间起屏障作用(图15)。
图14:荧光手术显微镜(A)和手术期间PDS的场景(B和C)
全尺寸下载
在此过程中,我们通过浸泡局部应用AO,以在宏观肿瘤切除后暴露残留的肿瘤碎片。如果在切除前对包封的肿瘤进行相同的操作,AO将不会有效地积聚在肿瘤组织中,包括在间质基质或细胞中,因为肿瘤囊在非酸性正常细胞和酸性癌细胞外液之间起屏障作用(图15)。
图16:通过全身给药AO在包封的肿瘤组织中的积累(见正文)
全尺寸下载
尽管我们从未尝试过对人体进行AO静脉内给药,但是在一项实验研究中,在以1μg/
ml的剂量对小鼠和狗给药AO后,未观察到严重的不良反应。我们建议在不久的将来,通过在IRB的批准下进行一项临床研究,来研究对人静脉内给药AO的安全性,因为在PDD中AO的全身给药要好于检测多种病灶(例如转移或传播要比地方行政部门高。
3)术中光动力疗法(iPDT)(图13E)
在iPDS之后,使用手术显微镜在氙气灯未过滤的光(大于5000 lx)的照射下,将术中AO-iPDT依次施用于肿瘤刮除区域10分钟。
4)术后放射动力疗法(RDT)(图13F)
在不冲洗AO溶液的情况下闭合手术伤口后,在AO-RDT的放射治疗室中一次通过5 Gy的X射线辐射立即将AO-RDT应用于切除区域[24,29-31] 。
耐心
经我院IRB批准,这67例高级别恶性肌肉骨骼肉瘤患者接受了AOT。在充分解释了临床研究的方法/目的后,在获得患者和/或其近亲的同意下进行治疗。
51例软组织肉瘤患者包括滑膜肉瘤,横纹肌肉瘤,MHF,平滑肌肉瘤等高度恶性肉瘤患者,15例骨肉瘤患者还包括骨肉瘤和尤因氏肉瘤等高度恶性肉瘤。肉瘤。
临床结果
在我们的研究中,对临床结局的分析表明,在57例软组织肉瘤患者中,五年生存率(SR)为67.8%,五年局部无复发率(LRFR)为71.2%。根据AJCC分类,II期病例的SR为100%,III期病例的SR为86.7%,IV期病例的SR为0%,II期病例的LRFR为92.3%,III期病例为64.3%,60.2第四阶段病例的百分比。关于根据肿瘤大小分类的结果,直径小于10厘米的肿瘤的LRFR为78%,而较大肿瘤的LRFR为46.2%(图2)。另一方面,在15例恶性高级别骨肉瘤中,SR为85.7%,LRFR为93.8%(图3)。因此,虽然AO-PDT后的局部控制率可能不优于常规宽切除术后的局部控制率,但肢体残余功能却比宽切除后的更好。参与本研究的大多数患者表现出出色的肢体功能,可以快速奔跑,跳跃,游泳和投球[31]。
我们相信,参加本研究的所有患者都将以接近正常或至少没有残疾人的身份度过余生。对于肉瘤幸存者,尤其是儿童,维持良好的肢体功能非常重要,以确保手术后的长寿和高质量的生活。
AO的毒性和致癌性
通常认为,由于AO在细菌中是致突变性的[46-47],因此在人类中会致癌。但是,事实并非如此。已经进行了一些研究来研究AO的致癌性[48-49]。但是,没有任何证据表明AO具有致癌性。因此,世界卫生组织国际癌症研究机构(IARC)和其他官方报告并未将AO归类为致癌物[50]。除了我们的文献外,还有一些关于AO在人类临床研究中的应用的报道。已有两篇日本论文报道使用局部/口服AO来诊断宫颈癌或胃癌[51,另一本是日文]。最近,一个意大利研究小组报道的一项研究将我们的AO-RDT方法应用于滑膜肉瘤患者[52]。
2009年,美国的一个小组在经FDA批准的共聚焦激光腹腔镜活检的临床研究中也将AO应用于某些卵巢疾病患者[53]。在使用小鼠调查了AO的急性和慢性毒性及其致癌性之后,美国FDA已批准将AO用于特定的临床研究[54]。我们的小鼠研究表明,静脉内给药后AO的LD50为28-30
mg / kg [18]。研究了犬静脉注射0.1μg/ ml
AO的毒性,未发现明显的不良反应[55]。上述临床或实验报告均未显示由AO给药引起的任何严重并发症的证据。由于我们在目前的临床研究中使用的AO溶液浓度非常低,并且仅在局部给药,因此我们认为,我们的患者中AO致癌的风险显着低于大多数其他已知的抗癌药物代理商。
结论
总之,基于基础研究的结果和临床数据,我们坚信,由AO-iPDS,AO-iPDT和AO-RDT组成的AOT可能是一种有希望的新的肢体挽救方式,可以很好地保留肢体功能,肌肉骨骼肉瘤患者中局部肿瘤复发的风险低。这种治疗方式也可能适用于许多其他实体癌,尽管需要对大量具有较长随访时间的患者进行研究以证实这一观点。
在AOT程序中,iPDS可用于检测病变内肿瘤切除后的残留肿瘤组织,并使其易于使用荧光外科显微镜在荧光显像下精确地进行残留肿瘤组织的额外切除。
Cureus | Intraoperative Photodynamic Surgery (iPDS) with Acridine Orange for
Musculoskeletal Sarcomas
https://www.cureus.com/articles/2564-intraoperative-photodynamic-surgery-ipds-with-acridine-orange-for-musculoskeletal-sarcomas