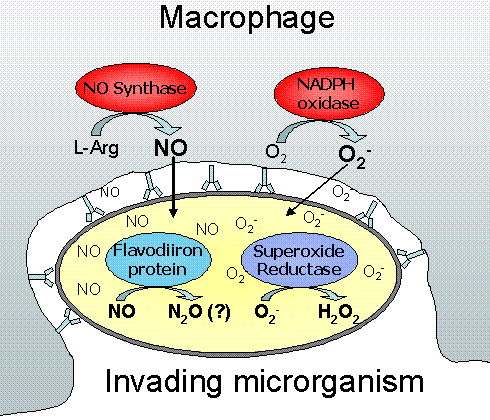
维生素C和巨噬细胞和GcMAF
维生素C增加活化巨噬细胞中一氧化氮的形成
Ascorbate-Dependent Enhancement of Nitric Oxide Formation
in Activated Macrophages
摘要
由细菌脂多糖(LPS)和细胞因子激活的巨噬细胞通过诱导iNOS基因表达产生一氧化氮(NO)。在干扰素-γ和LPS激活的老鼠巨噬细胞样细胞系J774.1,抗坏血酸盐增加氮氧化物(亚硝酸盐和硝酸盐)的形成大约40%。单独使用抗坏血酸对NO的形成无诱导作用。
NG一甲氧基精氨酸在有或无抗坏血酸激活的细胞中能亚硝酸盐的形成。
Western blotting分析显示,在抗坏血酸激活的细胞中,iNOSmRNA和蛋白质的稳态水平都比仅在诱导物激活的细胞中增加了大约两倍。
这些数据表明,抗坏血酸通过增加活化巨噬细胞中iNOS的数量来增加NO的产生。

Ascorbate-Dependent Enhancement of Nitric Oxide Formation in Activated Macrophages☆
Abstract Macrophages activated with bacterial lipopolysaccharide (LPS) and
cytokines produce nitric oxide through the induction of iNOS gene expression.
Ascorbate increased NOx (nitrite and nitrate) formation by approximately 40% in
a mouse macrophage-like cell line, J774.1, activated with LPS and interferon-γ.
Ascorbate alone exhibited no inductive activity toward NO
formation.NG-Monomethyl-l-arginine inhibited nitrite formation in cells
activated in the presence or absence of ascorbate. Northern and Western blotting
analyses showed that both iNOSmRNA and protein steady-state levels were
increased approximately twofold in cells activated in the presence of ascorbate
compared to in cells activated only with the inducers. These data suggest that
ascorbate increased NO production by increasing the amount of iNOS in the
activated macrophages.
Ascorbate-Dependent Enhancement of Nitric Oxide Formation in Activated
Macrophages☆
https://doi.org/10.1006/niox.1998.0182
NO-dependent biological actions of human macrophages

巨噬细胞产生一氧化氮:这是毫无疑问的
Nitric oxide production by human macrophages: there's NO doubt about it

NO合成酶从l-精氨酸中生成一氧化氮(NO)的发现彻底改变了我们对人类生理学许多方面的理解。自从Furchgott和Zawadzki(7)的开创性研究以来,NO。基于NO循环作用的新型药理学制剂已在临床得到广泛应用。然而,这与NO在抗感染中的作用形成了对比,后者的临床应用在很大程度上还没有被认识到。Hibbs等人的开创性研究(8)证明了小鼠巨噬细胞的非依赖性作用,这一研究已被证明对人类的推断更为困难。
由于无法证明巨噬细胞能否产生NO,最初造成了障碍。毫无疑问,在感染和其他炎症情况下,人类NO的分泌量显著增加(4,24)。然而,体外处理人类外周血单核细胞和脂多糖interferon-γ未能引起没有生产(15),即使这些刺激是高度有效地引发小鼠巨噬细胞产生大量的NO(19)。这导致一些研究者质疑人类巨噬细胞能够NO(15)。
这个问题的答案在过去10年的100多项研究中逐渐浮出水面。目前,人类巨噬细胞产生NO是不争的事实。在各种环境下(10,14,25),在活化的人巨噬细胞中重复发现了NO合酶mRNA和蛋白,同时也有生化证据表明NO的产生(23)。诱导型一氧化氮合酶(iNOS)蛋白已在感染患者浸润组织巨噬细胞中得到了令人信服的证明(1)。最近的研究发现,iNOS启动子多态性与巨噬细胞NO的产生和对感染的抵抗有关(11),这进一步支持了NO在人类先天免疫中的重要作用。在人巨噬细胞中显示NO的关键是允许刺激在体内发生。虽然在患有炎症的患者(如肺结核(12)、类风湿关节炎(18)或疟疾(2))的巨噬细胞中经常产生NO,但在健康受试者外周血单核细胞刺激NO产生的体外条件下仍不完全确定。
在这一期(参考文献9,参见第L944页)中,Hickman-Davis等人对促进人类巨噬细胞产生NO的条件列表进行了重要补充。一些健康肺移植患者的肺泡巨噬细胞在常规监测下进行支气管肺泡灌洗,而正常志愿者的巨噬细胞未发现自发产生大量的NO,在表面活性蛋白A
(SP-A)或肺炎克雷伯菌(liveKlebsiella pneumoniae)的刺激下,这些巨噬细胞进一步增强。值得注意的是,经sp -
a处理的细胞对克雷伯氏菌具有抗菌活性,而抑制NO的产生可以消除这种抗菌活性。这表明,移植的肺为宿主防御提供了一个促进抵抗细菌感染的刺激环境,并进一步证明了诸如SP-A这样的集合体可以以多种方式促进先天免疫。肺移植中局部NO合成的证实证实了早期的研究结果,即同种异体肺移植受者的支气管肺泡灌洗液中含有iNOS
mRNA(16)。虽然细菌性肺炎在肺移植后初期很常见(3),但肺泡巨噬细胞的激活可能有助于限制此后肺炎的发生。
Hickman-Davis et al
.(9)的尝试阐明体内信号从某些前提肺泡巨噬细胞移植患者合成没有回应SP-A,这个collectin增强吞噬细胞功能和生产的作用机制在人类吞噬细胞的抗菌活性不确凿。仅克雷伯氏菌引起的NO产量与SP-A相当,说明NO是SP-A的贡献因素,但不足以说明SP-A的抗菌作用。类似地,sp
-
a诱导的细胞内Ca2+的升高似乎是这些作用的必要条件,但在移植患者和正常对照组的巨噬细胞中均有发生。希克曼-戴维斯和他的同事证明,由黄嘌呤/黄嘌呤氧化酶系统产生的一氧化氮和活性氧可以在体外迅速杀死克雷伯塞兰。然而,这不大可能解释体内肺泡巨噬细胞中观察到的弱的且主要的抑菌作用,而且研究人员也没有提供巨噬细胞产生活性氧的证据。巨噬细胞来源的NO的抑菌作用实际上与小鼠细胞中观察到的NO依赖性抗菌作用一致(22)。NO通过亚硝基化的硫醇和金属来可逆地抑制必要的细胞过程的能力为抑菌提供了一个机械原理(17)。除了直接的抗菌活性外,可以认为肺泡巨噬细胞的NO依赖作用与NO的多效性基因调控作用有关(5,17)。支持这一假说的是,NO在小鼠肺炎克雷伯氏菌感染模型中的保护作用与其作为促炎介质表达的调节剂的作用相关(20)。
NO参与多种调控和细胞毒性作用的能力(6)给阐明其在复杂生物系统(如移植肺)中的精确分子机制带来了持续的挑战。然而,Hickman-Davis等人(9)的观察强化了NO是人类先天免疫的重要中介的信息。未来的传染病治疗策略可以设计为增加感染部位NO的产生或抑制其有害的副作用(21)。尽管研究人员花了一些时间,但巨噬细胞最终学会了拒绝。
Nitric oxide production by human macrophages: there's NO doubt about it |
American Journal of Physiology-Lung Cellular and Molecular Physiology
https://www.physiology.org/doi/full/10.1152/ajplung.00017.2002
一氧化氮合成在巨噬细胞抗菌活性中的作用
过去5年的研究表明,小鼠巨噬细胞的免疫激活诱导了一氧化氮合酶的活性,该酶氧化l
-精氨酸的胍氮,产生瓜氨酸和活性自由基一氧化氮。对巨噬细胞中该通路的生物化学和免疫调节的综述为评估其效应功能提供了背景。过去2年发表的报告表明,一氧化氮的合成介导了小鼠巨噬细胞对某些真菌、蠕虫、原生动物和致病菌的抗菌活性。
Role of nitric oxide synthesis in macrophage antimicrobial activity
Research over the past 5 years has demonstrated that immunologic activation of
mouse macrophages induces the activity of nitric oxide synthase, which oxidizes
a guanidino nitrogen of L-arginine, yielding citrulline and the reactive
radical, nitric oxide. A review of the biochemistry and immunologic regulation
of this pathway in macrophages provides a backdrop against which to evaluate its
effector functions. Reports published in the past 2 years suggest that synthesis
of NO mediates much of the antimicrobial activity of mouse macrophages against
some fungal, helminthic, protozoal and bacterial pathogens.
Role of nitric oxide synthesis in macrophage antimicrobial activity -
ScienceDirect
https://www.sciencedirect.com/science/article/abs/pii/095279159190079G
GcMAF的书,第六章
你的巨噬细胞杀手
Your Awesome Macrophage Killing Machine
巨噬细胞是巨大的、聪明的白细胞,它追逐、捕获、吞噬并消化入侵者。它们诱捕并吞噬(字面意思是“吃掉”)它们的敌人。它们可以在必要时迅速繁殖。然而,它们天生懒惰,需要被GcMAF激活。Opsonin“超级胶水”帮助它们粘住猎物。它们的电子驱动的自由基死亡射线(又称“氧化爆炸”)会在微生物和癌细胞上炸开孔洞。一旦一个微生物或癌细胞被宏体吞噬,它就被封装在一个“吞噬溶酶体”(细胞内的“死亡腔”)中,在那里它被杀死(如果它还没有死的话),然后被分解成它的组成部分,然后被循环利用。
虽然我已经描述了巨噬细胞,但这些大型免疫细胞对于理解GcMAF如何工作非常重要,因此我需要更详细地介绍它们。此外,它们是真正迷人的动物!
如果你能想象一个活着,呼吸着,渗出,巧妙地可怕的巨大无比的粘性blob金刚的危险的恶魔的特性相结合的威胁大小,汉尼拔Lechter同类相食,达斯·维达的光剑,终结者,李小龙,棉花糖的人,在纽约Ghostbusters-all滚成一个巨大的杀戮机器会有一些想法的巨噬细胞。他们大。他们是令人讨厌的。如果你是细菌、病毒或癌细胞,你会尽最大努力避开它们。
巨噬细胞是巨大的
巨无霸有多大?相比之下,红细胞、白细胞和典型的癌细胞直径约为7微米(微米或百万分之一米),体积约为250立方微米。巨噬细胞直径约为20微米(2千万分之一米),约为正常细胞的三倍宽。但是,因为一点点额外的宽度转化成大量额外的体积,巨噬细胞——大约4000立方的微粒——有大约16倍于正常大小细胞的体积。如果一个癌细胞有一辆丰田皮卡那么大,巨噬细胞就会比一辆18轮大。
不是哑巴卡车
但这个庞然大物并不是一辆愚蠢的卡车。它装备了大量武器,装备了一系列令人生畏的高科技系统,其目的只有一个:尽可能迅速有效地消灭敌人。我们称之为“杀瘤能力”。
它是这样工作的。当巨噬细胞不在血液中游动时,它可以利用自己产生的粗短的(1微米)“腿”(大约每次10个)在组织中缓慢“行走”。巨噬细胞慢慢靠近并与“外来入侵者”(如癌细胞或病毒粒子)相依偎,迅速将其识别为敌人,并向其喷射装有自由基的Darth
Vader死亡光束,抓住、吞噬、窒息、杀死并消化它。如果敌人离得更远,或者试图逃跑,宏体就会紧追不舍,挤出一串细长的、像意大利面一样的触手,缠绕住逃亡的细胞,用牢不可破的钳子紧紧抓住它。
在一个被称为吞噬作用的过程中,巨噬细胞吸引受害者,吞噬并使其窒息,然后将其包裹在细胞质内的一个小泡样囊肿中(称为吞噬溶酶体)。吞噬溶酶体分泌出一种具有腐蚀性的自由基和酶的混合物,这些自由基和酶能迅速地将被吞噬的物质分解成它的组成部分(氨基酸、核酸、脂肪酸等)。巨噬细胞随后将这些碎片吐入细胞间“汤”。因为病毒和癌细胞的残留物是细胞的基本组成部分,人体会利用这些“零件”迅速地对它们进行回收利用,从而制造出全新的健康细胞。
我发现这个复杂的、真正暴力的场景每分钟在你和我身上发生数十亿次,这完全令人惊奇。
巨噬细胞最重要的武器综述:
伪足
字面意思是“假腿。它们可以是短而粗的,例如,宏是为了沿着血管内壁“行走”而产生的。然而,对于追捕和抓逃犯,宏可以制造出更长的伪足,延伸出相对较长的距离(也许60微米)。想象一下,一个大众汽车(Volkswagen)大小的宏,能够将数百条细长的手臂(每条手臂的直径大约相当于一根排气管的直径)伸展到50英尺或更高。一旦到了那里,它们就能把自己织成一张网,把不幸的敌人困住。如果这个目标是一个癌细胞,那么它大概有一辆摩托车那么大。如果是一种细菌,它的大小将和旱冰鞋差不多。
巨噬细胞来诱捕细菌
吞噬作用和吞噬溶酶体形成
一旦伪足缠住了猎物,吞噬过程就开始了。离微生物或癌细胞最近的伪足类动物的外膜只是简单地融合在一起,这样受害者就被完全包裹在所谓的吞噬溶酶体中。(“Phago”的意思是“吃”,“lyso”的意思是“消化”,“some”的意思是“细胞”或“身体”。)然后,包围吞噬溶酶体的膜向捕获的猎物发射更多的死亡射线(只是为了确保它是死的),并通过一系列的腐蚀性酶来消化它。更多关于吞噬溶酶体的内容待会介绍。
想要观看一段关于白细胞(中性粒细胞)追逐并吞噬细菌的精彩视频,请点击这里:
http://www.youtube.com/watch?v=MgVPLNu_S-w&NR=1
(这是中性粒细胞,不是巨噬细胞;巨噬细胞的大小大约是它的16倍。)
Opsonins:超级胶水“结合增强剂”,帮助宏锁定敌人
为了帮助它们抓住猎物,巨噬细胞向附近的淋巴细胞发送信号,指示它们在潜在的猎物上喷涂一层薄薄的粘性蛋白。然后,当宏的细长手臂与微生物或癌细胞接触时,这种“超级胶水”涂层会变硬,使亡命之徒无法摆脱。
通常情况下,一个宏会发出一群(比如20个左右)黏糊糊的伪足来包围敌人的细胞,把它包裹在一个类似网的东西里,就像一个巨大的渔网,微生物或癌细胞就会落入其中。就像飞行纸上的苍蝇一样,敌人的细胞既卡在里面也卡在里面,所以没有办法逃脱。然后,猎物逐渐被包围和吞噬,最后以吞噬溶酶体的形式舒服地进入巨体,在被各种自由基和酶消化成其组成部分之前,它在巨体中度过生命的最后时刻。
这种粘性蛋白被称为“结合增强子”或“opsonins”。粘合的过程叫做“opsonization”。
有趣的是,当一个宏抓住敌人这种方式,但它要吞噬其他士兵知道附近猎物,就像一个孤立的士兵偶然发现一群敌军,并呼吁备份蛋白质——它发出信号告诉附近的巨噬细胞,使更多的受体,专门从事专门抓这样的敌人。人多安全。(技术上称为“上调相邻吞噬细胞上补体受体的表达”。)
“氧化爆炸”产生的电子死亡射线
我最喜欢的巨噬细胞武器是“氧化爆发Oxidative Blast”(也就是众所周知的“呼吸爆发Respiratory
Blast”),因为它是如此的复杂,就像《星球大战》里的情节一样。这是达斯·维达的死亡射线。位于微型机外膜的一种酶(称为NADPH氧化酶)会喷射出一束高活性的自由电子,就像机关枪发射的子弹一样。
还记得那些有显像管的旧电视机吗?NADPH枪就是这样的。在电子管的后面,电子枪瞄准了屏幕上的磷光粒子。当电子束击中粒子时,屏幕就会亮起来,形成一幅画面。同样,NADPH也发射粒子束。但它不是在播放《你好,杜迪》(Howdy
Doody),而是在把肿瘤细胞和微生物炸成碎片。
电子束中的电子一次一个地出现,但它们真的真的不想“自由”,所以它们尽可能快地攫取另一个电子,形成稳定的电子对(我们这里说的是纳秒)。氧化爆发所引发的电子攫取连锁反应会使癌细胞或病毒衣壳外壁的分子蒸发,并在其上撕开小孔。现在,把受害者连在一起的薄膜真的裂开了,里面的东西都流出来了。没有完整的外膜,癌细胞无法存活很长时间。
氧化爆发并不总是发生。那将是对火力的浪费。启动它的“触发点”是“敌人”、癌细胞、艾滋病毒、肝炎病毒或细菌的近距离接触。当一个宏与“敌人”直接接触时,它才会打开电子束。
我们的身体里到处都是氧分子。(我们需要大量的氧气和葡萄糖,这些“燃料”是我们产生“能量”的来源,这些“能量”推动着所有的细胞化学反应,使生命成为可能。)当它们被释放时,死亡射线束中的大多数电子会撞向这些无处不在的氧分子中的一个,从这些氧分子中它们会迅速地获得所需的电子,从而形成稳定的电子对。氧分子现在失去了一个电子,因此转变成强腐蚀性的自由基,称为“超氧化物”(O2-)。超氧化物需要电子,为了得到电子,它会摧毁一切。“任何东西”都可能是我们的宏用它的假足抓住的病毒、细菌或癌细胞。突然,入侵者发现自己的外膜上有一个大洞。它很快就会死的。
自由电子和超氧化物也会引发连锁反应,形成其他活性自由基。其中之一是羟基离子(OH-)。这是过氧化氢,就像那个棕色瓶子里的东西一样,但是它的效力是它的33倍——一个局部产生的细胞间剂量。非常适合煎炸微生物和肿瘤细胞。
通过氧化无处不在的氯原子,电子束还会产生有害的次氯酸(HClO),它可以在任何平面的敌人膜上戳一个洞。现在我们有了一锅有毒的自由基氧化剂,可以对我们的敌人造成巨大的局部伤害。
/媒体/图片/ hypochlorous-acid.gif
“等一下,”(我能听到你在说)“为什么我们自己的细胞没有被友军的炮火破坏呢?”它们如何逃脱死亡射线?“伟大的问题。我们有一个保护屏障,防止自由电子和自由基破坏我们自己的细胞。它被称为SOD(超氧化物歧化酶),是一种专门在超氧化物和其他自由基破坏我们的细胞之前中和它们的酶(一种大型蛋白质分子)。为了最大程度的保护,SOD被放置在巨噬细胞外壁(或膜)NADPH死亡射线产生蛋白的旁边。
“桶”(NADPH分子)宏观electron-generating死亡射线枪的目的是向外的细胞伸出的一个小洞被SOD分子包围和保护,形成一种“掩体”保护电子枪和巨噬细胞的细胞。只要我们不停地造草皮(如果我们停下来,几分钟内就会死掉),我们就安全了;电子束不会伤害我们。这是一个非常酷的组合:一个可笑的致命武器,为用户提供内置的安全保护(就是你)。
gcmaf激活的宏与“氧化爆发”
你以前听过这个,但是我必须再说一遍:只有GcMAF激活的宏才能产生足够有效的氧化爆发。如果来自病毒或癌细胞的Nagalase让宏进入睡眠状态,氧化爆发就会退化成一个不会伤害任何人的小土豆枪。火力——或者说缺乏火力——是我们在这里讨论的问题。还记得那些以六发为主的西部片吗?这里有一个镜头,长时间的停顿,然后那里有另一个镜头?两声枪响之间有一段很长的间隔,你甚至能听到弹回的声音。这是一个失效的mac:在抽签的时候速度很慢,投篮次数也不多。难怪印第安人会做奶油蛋糕。被激活的宏每秒发射相当于数百万发子弹的原子子弹,而且永远不必停下来重新加载。一些新上映的电影中有太多的子弹从各个方向飞来,很难理解人们是如何生存下来的。这是只有gcmaf激活的巨噬细胞才能提供的那种火力。
吞噬溶酶体行刑室(和拆除室)
如果一个微生物或癌细胞以某种方式在氧化爆发和吞噬作用后存活了下来,那么它将无法在死亡之室中存活。巨噬细胞一旦被吞噬、内化并嵌入到巨噬细胞的细胞质中,敌人就被囚禁在巨噬细胞(称为吞噬溶酶体)内部的一个圆形囊泡中,各种消化酶和更多的氧化过程被喷射到这个囊泡中。漂亮的事情不会发生在吞噬溶酶体内部。如果癌细胞或微生物尚未死亡,吞噬溶酶体的“死亡室”肯定会将其消灭(“吞噬”的意思是“吃掉”)。“Lyso”的意思是“解散”。"
Some "是" sack "或" bag "的意思。
一旦分解过程完成,吞噬溶酶体滑过并与外细胞膜接触,与之融合,然后将现在无害的分解产物(核酸、脂肪酸、氨基酸等)释放到细胞外液中。然后,它们被附近的细胞吸收,再循环成新的身体部位。我们当中有生态意识的人应该会发现这个过程的效率是值得赞扬的。没有什么是浪费。可怕的有毒的坏人被杀死,拆除,并转化为备件的好人:我们。
复杂的通信系统
谈谈通信系统吧!免疫细胞——巨噬细胞和淋巴细胞——不停地胡扯,就像一个巨大的市政厅聊天室,每个人都在同时交谈。然而,由于说话是“信使分子”的一种释放,而倾听是由蛋白质受体完成的,免疫细胞实际上可以边听边说话!!没有必要抱怨被打扰!这很奇怪,而且对我们人类来说很陌生,但是这种同时说话和倾听的方式比每次别人说话时你停下来听他说话要快得多(就像我们人类通常做的那样)。
这里有太多的活动,伴随着不断的分子振动和疯狂的细胞争抢,以尽可能快的速度抓住并杀死敌人的细胞,以至于偶然的观察者可能会得到混乱的印象。但她可能大错特错了。这里没有白费的努力。就像贝多芬的交响乐一样,一切都组织得非常好,协调得非常好。
巨噬细胞和其他免疫细胞之间的化学反应是如此迅速和有效,以至于一个复杂的军事通信系统看起来就像一群拿着锡罐电话的孩子。宏释放大量的信使分子(细胞因子、干扰素、白三烯和其他小分子)——每个细胞每秒释放数千个分子。每个分子携带一个特定的请求或命令。比如“给我这个”,或者“我们需要一些那个”,或者“杀死所有看起来像这样的东西”。“我们这里需要炎症反应。”或者“我们不需要再这么做了。”“他们讨论敌人的长相和侵略性。他们告诉彼此如何努力工作。它们标记目标以供其他细胞识别和杀死。他们谈论敌人的藏身之处。他们讨论当前的敌人战略,以及如何最好地战胜它。
指数自我克隆:终极武器
最后,但绝对不是最不重要的一点是,如果宏的能力超过了宏,那么它们就会打出人口牌:它们会迅速繁殖。当他们发现自己处在一个癌细胞或病毒粒子密度高的区域时,他们不需要召集更多的部队;他们只是克隆自己,在很短的时间内就能做到。更多的宏会自动转换成上面列出的更多的其他武器。但是,这个乘法过程只发生在激活的宏中。
GcMAF激活
没有GcMAF,宏就会衰退。在有GcMAF存在的情况下,它们的活动水平呈指数级增长。一旦被激活,宏就会迅速繁殖并进行猛烈的攻击。在下一章中,我将解释为什么……
Chapter 6: Your Awesome Macrophage Killing Machine
http://gcmaf.timsmithmd.com/book/chapter/15/
GcMAF作为一种癌症治疗
它能治疗癌症吗?

GcMAF是什么?
GcMAF是一种维生素d结合蛋白。它被科学地称为Gc蛋白衍生的巨噬细胞激活因子。它是一种支持免疫系统的蛋白质,自然存在于人体中。GcMAF激活巨噬细胞,即负责抵抗感染和疾病的细胞。
GcMAF和癌症
GcMAF是一种天然存在于体内的维生素蛋白。它激活负责组织修复的细胞,并启动针对感染和炎症的免疫反应,因此它可能有杀死癌细胞的潜力。
免疫系统的作用是保护身体免受细菌和感染。然而,如果癌症在体内形成,这些防御细胞及其功能就会被阻断。
癌细胞和肿瘤释放一种叫做nagalase的蛋白质。当它被释放时,它会阻止免疫系统细胞正常工作。然后,GcMAF蛋白被阻止转化成一种增强免疫反应的形式。如果你的免疫系统不能正常工作,你可能无法抵抗感染和癌细胞。
GcMAF作为一种实验性癌症治疗
由于GcMAF在免疫系统中的作用,有一种理论认为这种蛋白的外部发展形式可能有治疗癌症的潜力。该理论认为,通过向体内注射外部的GcMAF蛋白,免疫系统可以更好地工作并对抗癌细胞。
这种治疗方法还没有被批准用于医学用途,而且是高度实验性的。最近一期临床试验正在研究一种由天然Gc蛋白开发的癌症免疫疗法。然而,没有研究结果被公布。这是第一次使用既定的研究指南来检验这种治疗方法。
某些机构以往关于这种治疗方法的研究受到了质疑。在一个案例中,关于GcMAF和癌症的研究被撤回。在另一个案例中,发布信息的研究小组也销售蛋白质补充剂。因此,存在利益冲突。
GcMAF疗法的副作用
根据2002年发表在《国家癌症研究所期刊》上的一篇关于GcMAF的文章,接受纯化GcMAF的小鼠和人类没有“毒性或负性炎症”副作用。
的前景是什么?
作为一种可能有效的癌症治疗手段,GcMAF疗法仍在研究中。然而,需要注意的是,GcMAF补充剂并没有被批准用于治疗癌症或其他健康问题。
不建议你放弃传统的癌症治疗选择而选择GcMAF疗法。由于研究的完整性,很少有关于GcMAF治疗癌症的数据是值得怀疑的。在某些情况下,研究人员为生产这种药物的公司工作。在其他情况下,这些研究发表后又被撤回。
还需要进行进一步的研究。在此之前,GcMAF在癌症治疗中的任何有益作用都是不确定的。
GcMAF and Cancer: Get the Latest Information
https://www.healthline.com/health/gcmaf-cancer-treament#outlook
巨噬细胞和酒精相关的肝脏炎症
Cynthia Ju博士和Pranoti Mandrekar博士。
Cynthia Ju博士是科罗拉多大学安舒茨医学校区斯卡格斯药学院的教授。
Pranoti Mandrekar博士是马萨诸塞大学医学院医学系的教授。
最近的研究表明巨噬细胞在酒精诱导的肝脏炎症的发展中起着关键作用。为了准确定义酒精性肝病(ALD)中这些细胞的致病功能,在临床环境中进行广泛的研究以进一步阐明ALD下巨噬细胞的表型多样性是非常重要的。迄今为止的研究已经确定了巨噬细胞的几个特点,包括巨噬细胞的极化和表型多样性。其他的分析主要集中在巨噬细胞/单核细胞的浸润与驻留,以及巨噬细胞介质在肾上腺脑白质营养不良发展中的作用。研究结果提示巨噬细胞可能成为酒精性肝损伤的治疗靶点。未来的研究将致力于了解酒精如何影响肝脏和其他组织的巨噬细胞表型转换,肝脏微环境是否决定巨噬细胞在ALD中的功能,以及巨噬细胞的靶向是否能减轻酒精性肝损伤,这些都将为酒精性肝炎患者的治疗提供有希望的策略。
关键词:酒精消费;酒精性肝病;酒精性肝损伤;酒精性肝炎;酒精肝发炎;肝;免疫力;先天免疫反应;适应性免疫反应;巨噬细胞;巨噬细胞表型转换;枯氏细胞
酒精性肝病(ALD)是一种影响全球数百万人的复杂疾病,最终可导致肝硬化和肝癌(即肝硬化)。肝细胞癌)。除了酒精及其代谢物乙醛对肝细胞的直接细胞毒性和氧化应激介导作用外,摄入酒精还会激活肝脏的先天和适应性免疫反应。这些反应涉及多种肝细胞类型,包括驻留巨噬细胞、自然杀伤细胞、自然杀伤T细胞、淋巴细胞和中性粒细胞。特别是,肝脏中的巨噬细胞,也称为库普弗细胞,对于清除肝脏中的病原体,包括细菌、病毒、免疫复合物、称为内毒素或脂多糖(LPS)的细菌产物和肿瘤细胞非常重要(Jenne和Kubes
2013;汤姆森和诺尔(2010)。近来,诸如宿命定位、多焦点显微镜、转基因/报告小鼠模型和下一代测序等研究工具使人们更好地了解巨噬细胞及其循环前体细胞(即巨噬细胞)的起源、异质性和表型和功能的可塑性。单核细胞)。
肝内循环单核细胞的激活和巨噬细胞的聚集是ALD患者重要的病理生理特征。然而,肝巨噬细胞在ALD发病机制中的作用尚未完全阐明。本文将讨论单核细胞/巨噬细胞生物学方面的一些新发现,更新目前关于肝巨噬细胞在肾上腺脑白质营养不良中的研究进展,并确定有待解决的问题,以开发针对肾上腺脑白质营养不良的巨噬细胞靶向治疗。
单核细胞和巨噬细胞表型和功能的异质性
巨噬细胞主要分为两大类:浸润性巨噬细胞和组织驻留性巨噬细胞,巨噬细胞在机体对病原体或其他损伤的初始先天免疫应答中起重要作用。浸润的巨噬细胞来自于称为单核细胞的前体细胞,单核细胞在体内循环,当炎症反应发生时,巨噬细胞被吸收到组织中。相比之下,组织驻留的巨噬细胞则始终局限在一个组织内,充当哨兵和第一道防线,抵御该组织中的任何感染或损伤。
巨噬细胞存在于各种组织中,如大脑、皮肤、肺、肝和脾。组织驻留的巨噬细胞根据其驻留组织表现出多种表型和功能,这就提出了这些细胞起源的问题(Davies et
al.
2013)。最近的脂肪定位研究显示,胚胎卵黄囊和/或胎儿肝脏前体细胞是许多组织驻留巨噬细胞的来源,例如那些在肝脏中的巨噬细胞。皮肤和中枢神经系统(Gomez
Perdiguero和Geissmann 2013)。组织驻留的巨噬细胞被定义为一个异质性的免疫细胞群,对维持特定组织的稳态功能非常重要(Davies et
al.
2013)。组织巨噬细胞是自我更新还是从骨髓中不断补充仍是一个有争议的问题。然而,大量证据表明,骨髓来源的循环单核细胞可以在组织炎症早期被招募到损伤部位,并在那里分化为巨噬细胞。经典单核细胞和非经典单核细胞根据损伤的性质(如感染或梗死)和损伤组织按顺序招募。此外,据报道,驻留的巨噬细胞和募集的单核细胞都能够在某些细胞因子(如白细胞介素(IL)-4)的诱导下进行自我更新(Jenkins等,2011年)。
肝脏中的库普弗细胞是组织内巨噬细胞中数量最多的,是肝脏炎症反应的主要来源。Kupffer细胞的先天免疫功能不仅在机体对肝脏损伤的反应中起关键作用,而且在肝脏对抗原的致情反应中起关键作用。库普弗细胞位于肝窦,主要分为两个亚群(Klein
et al. 2007):
放射敏感的巨噬细胞迅速被造血前体细胞取代,在炎症反应中起重要作用;和
不参与炎症灶的耐辐射、长寿的库普弗细胞。
小鼠模型常被用来研究巨噬细胞功能的各个方面。然而,与单核细胞前体一样,当使用小鼠作为疾病的临床前模型时,必须考虑小鼠和人类巨噬细胞特征的差异(Mestas和Hughes
2004)。例如,小鼠和人类巨噬细胞在被称为toll样受体(TLRs)的表面分子的表达上可能有所不同,TLRs参与巨噬细胞的激活、对免疫激活剂的反应以及产生一氧化氮。
巨噬细胞极化
巨噬细胞有一种独特的能力来改变其表型和功能,这取决于组织微环境的提示,如细胞因子、生长因子、病原体相关分子模式分子(PAMPs)和损伤相关分子模式分子(DAMPs)的存在。这个过程被称为极化,并导致两种巨噬细胞表型的出现,分别标记为M1和M2巨噬细胞。M1巨噬细胞主要具有促炎作用。例如,经典活化的M1巨噬细胞帮助介导对细胞内细菌和病毒的初始防御;此外,它们对组织损伤的反应也很重要。M1巨噬细胞产生促炎和压力介质和细胞因子,如il
- 1、肿瘤坏死因子α(TNFα)、γ干扰素、白介素,地震,一氧化氮,和活性氧(ROS),并能激活适应性免疫反应(Jouanguy et al .
1999;Shaughnessy和Swanson 2007)。一旦感染或损伤被控制,巨噬细胞转化为抗炎、组织修复表型,以控制过度的组织损伤炎症反应(Benoit
et al.
2008;Noel等人,2004)。这些细胞通常被称为或者激活巨噬细胞(M2),帮助促进炎症和组织修复的决议(西卡和多亏尤文和2012)(见图1)。它们可以区别M1巨噬细胞的存在高水平的几个标记蛋白质(如Fizz1,
Mrc1 Ym1, __arg1)(戈登2003;Mantovani等,2002)。

图1巨噬细胞可塑性及其参与组织损伤的示意图。在炎症反应的起始阶段,巨噬细胞被募集到损伤或感染的部位具有M1表型。他们生产促炎症和压力介质和细胞因子,如肿瘤坏死因子α(TNFα)、白介素(IL) 1到-12年,干扰素γ(IFNγ),酶生成一氧化氮(间接宾语),和活性氧(ROS)。这些巨噬细胞具有促炎和抗菌作用,并导致基质降解和组织破坏。在决议阶段的损伤,这些M1巨噬细胞转化成一个平方米表型不同的细胞因子和趋化因子,il - 10、转化生长因子β(TGF-β)、基质金属蛋白酶(MMPs),精氨酸酶1 (__arg1),组织金属蛋白酶抑制剂(TIMPs)和血管上皮生长因子(VEGF)。这些M2巨噬细胞具有抗炎作用,促进血管形成(血管生成)、基质合成和组织重塑。
巨噬细胞的功能异质性反映在其在各种疾病中的不同(有时相反)的作用(Sica和Mantovani
2012)。例如,虽然M1细胞在急性感染期间对清除细菌和病毒至关重要,但M1反应失调可能导致附带组织损伤。因此,M1巨噬细胞的促炎功能导致自身免疫性疾病(如关节炎和多发性硬化)和代谢性疾病(如胰岛素抵抗、糖尿病和动脉粥样硬化)。类似地,虽然M2巨噬细胞常与组织修复和免疫调节相关,但过多的M2反应可导致慢性疾病,如特应性皮炎、哮喘和组织纤维化。此外,随着时间的推移,由于组织环境的变化而导致的细胞表型改变的疾病也可能伴随着巨噬细胞表型的改变(即巨噬细胞表型的改变)。巨噬细胞可塑性)。例如,在癌症早期,肿瘤相关的巨噬细胞类似于经典激活的M1细胞,可以促进抗肿瘤免疫反应。然而,随着肿瘤的进展,这些与肿瘤相关的巨噬细胞转变为调控表型,抑制抗肿瘤免疫并促进肿瘤生长(Allavena
et al.
2008)。另一个例子是,非肥胖个体中的脂肪组织巨噬细胞主要表现为创伤愈合表型,很少产生促炎细胞因子。然而,在肥胖患者中,脂肪组织巨噬细胞转变为促炎性m1样表型,其特征是细胞因子的产生导致胰岛素抵抗(Zeyda和Stulnig
2007)。
虽然将巨噬细胞分为M1和M2细胞很方便,但需要注意的是,这种划分过于简单。M1和M2巨噬细胞仅代表全谱表型的两个极端,在这两种类型中都有具有不同表型和功能的亚群。例如,M2细胞可以分为至少两种亚型:伤口愈合型和免疫调节型巨噬细胞(Edwards
et al.
2006)。伤口愈合的巨噬细胞在各种类型的白细胞释放的细胞因子IL-4和IL-13的作用下形成。与M1巨噬细胞相比,这些细胞产生的促炎细胞因子、ROS和一氧化氮水平低得多,但促进组织再生和伤口愈合的分子水平高得多(如甘露糖受体、细胞外基质成分和调节基质重建的因子)。相反,免疫调节巨噬细胞出现在适应性免疫反应的后期或应激诱导的糖皮质激素上调的反应中。这些巨噬细胞的特点是产生高水平的IL-10。诱导免疫调节巨噬细胞产生的因子包括免疫复合物、前列腺素、凋亡细胞、腺苷、组胺和脂联素。与伤口愈合巨噬细胞不同,调节巨噬细胞不诱导细胞外基质重构。
巨噬细胞表型的可塑性受多种细胞内分子机制控制,包括信号蛋白、转录因子和表观遗传事件。例如,巨噬细胞通过TLRs和干扰素受体的激活,诱导了一种涉及STAT1、2分子的信号机制,使其向M1表型方向极化(Qin等,2012年)。相反,通过IL-4/IL-13和stat6介导的机制的选择性激活产生M2表型(Daley等,2010;莫雷诺等,2003;Stolfi et al. 2011)。其他m2样表型是通过IL-10/STAT3和IL-3/STAT5信号机制诱导的(Sica和Mantovani 2012)。巨噬细胞极化的另一个重要调节因子是使STAT6磷酸化的JNK酶(Shirakawa et al. 2011)。缺乏JNK激活剂MLK3的肥胖小鼠缺乏M1巨噬细胞极化,提示JNK在M1表型的激活中起作用(Gadang等,2013年)。调节某些基因转录的IRF蛋白也是巨噬细胞极化的重要调控因子。例如,IRF5的活性促进了IL-12基因的转录并与M1表型相关,而IRF5的抑制则诱导了IL-10,导致了M2表型(Krausgruber et al. 2011)。类似地,激活一个名为Notch/IRF8的调节蛋白复合物会导致M1极化(Xu et al. 2012),而激活M-CSF/IRF4会导致M2极化。另一类被称为SOCSs的蛋白质也起着巨噬细胞极化的重要调节作用,其特异性的细胞因子刺激和SOCS亚型参与决定了细胞是否具有M1或M2表型。因此,il - 4的存在作用于SOCS1 / STAT1诱发M1表型(Whyte et al . 2011年),而干扰素γ与TLR可以诱导SOCS3 / STAT3和导致M2巨噬细胞极化(阿诺德·et al . 2014年)。各种受体位于细胞的细胞核,如分子称为PPARγPPARδ,Krupple喜欢4,和原癌基因也导致巨噬细胞极化的下游世界宗教自由/ STAT-SOCS通路(周et al . 2014年)。最后,在不改变DNA序列的情况下影响DNA结构和基因表达的调控过程。促进M2表型的诱导,抑制m1特征基因(Banerjee et al. 2013;Satoh等人,2010)。这些表观遗传调控因子包括组蛋白去甲基酶、Jumonji D3和microRNA let-7c。
在ALD中,巨噬细胞印记和M1或M2表型的极化受到肝脏中细胞因子介质的影响。对ALD时肝脏中细胞因子和应激蛋白激活的通路的详细研究,将有助于深入了解肝内巨噬细胞的极化。
巨噬细胞在退化
巨噬细胞在ALD营养不良中的意义
巨噬细胞似乎在肾上腺脑白质营养不良中起着中心作用。事实上,最近的研究结果表明,在ALD中不同类型的巨噬细胞共存和复杂的相互作用(Lee et al.
2014)。因此,对酒精性脂肪性肝炎患者的肝脏样本进行免疫组织化学分析,发现了表达受体和细胞因子的巨噬细胞,这些受体和细胞因子通常与M1细胞相关,同时也与M2细胞相关。大量其他分析表明,巨噬细胞功能可能与酒精性肝炎和纤维化患者的疾病状态存在临床相关性,具体如下:
巨噬细胞数量的增加在两个早期都有报道(即,脂肪肝)和晚期(即(Karakucuk et al. 1989),尽管巨噬细胞数量与疾病严重程度之间没有明确的相关性。
单核细胞趋化因子参与招聘的水平,尤其是MCP-1 MIP-1α,MIP-1β,增加患者的肝脏ALD (et al . 1998年)。
在基因表达谱分析中,炎症基因在酒精相关肝硬化患者巨噬细胞中的表达高于丙型肝炎病毒相关肝硬化患者巨噬细胞中的表达(Tapia-Abellan et al.
2012)。
单核细胞活化的因素,如新蝶呤和白细胞功能相关抗原3,在肾上腺脑白质营养不良患者中升高(Luna-Casado等,1997年)。
从ALD患者循环单核细胞表达和自发产生TNFαTNFα受体。在LPS刺激时,它们释放出更高水平的TNFα(Gobejishvili et al .
2006;张等,2001)。高度TNFα水平升高血液中,反过来,与贫穷有关结果在急性酒精性肝炎患者(鸟et al .
1990年)。在某些情况下,正常的抗炎细胞因子il - 10水平与未能抑制过度生产TNFα(Le Moine et al . 1995年)。
酒精性肝炎和/或肝硬化患者的其他细胞因子(如IL-6、IL-8和IL-18)和循环单核细胞和肝巨噬细胞产生的趋化因子水平升高(Afford et al.
1998;Fisher等人,1999)。这些增加的细胞因子水平与临床结果相关(Khoruts et al. 1991;麦克莱恩和科恩1989)。
酒精相关肝硬化患者肝脏样本的全球基因表达谱显示了独特的基因表达模式,在肝硬化的早期和晚期各不相同。肝硬化早期较晚期高表达的基因包括与巨噬细胞活化、增殖和迁移相关的基因(Lederer
et al. 2006),强调巨噬细胞在ALD进展中的作用。
需要更多的临床研究来评估不同阶段ALD患者的巨噬细胞和循环单核细胞,以了解单核/巨噬细胞对疾病进展的确切功能贡献。
Kupffer细胞在ALD中的作用
Kupffer细胞是驻留在肝脏的巨噬细胞,通过CD14/TLR4受体复合物激活,以应对长期饮酒过程中LPS的肠易位增加,这可能导致酒精性肝损伤。动物研究显示,急性和慢性乙醇政府与CD14和TLR4的迹象激活的巨噬细胞在肝脏,包括upregulation
TNFαCD14和增加产量,MCP-1, ROS(榎本失败et al .
2001年)。此外,通过各种途径清除肝脏巨噬细胞可以预防酒精诱导的肝脏炎症(Koop等,1997;Petrasek等(2012),证实了诱导肝损伤需要细胞。
研究人员已经调查了饮酒是如何激活库普弗细胞的。ROS的产生可能是酒精性肝脏中Kupffer细胞对LPS增敏的机制之一(Thakur et al.
2006)。在长时间接触酒精的过程中,Kupffer细胞产生ROS,可能是通过一种参与肝脏酒精代谢的酶的诱导而产生的。(Kono et al.
2000)。活性氧生成在库普弗细胞活化中的关键作用也在研究中得到了证实。NADPH氧化酶)。这种归一化预处理ROS生产alcohol-fed老鼠以及减少信号分子的磷酸化ERK1/2和抑制生产的促炎细胞因子TNFα枯氏细胞(河野et
al . 2000;Thakur等人,2006)。
在酒精介导的库普弗细胞活化中,另一个重要的成分是CD14/TLR4受体复合物。lps诱导的Kupffer细胞上这种受体复合物的激活会触发下游信号激酶(即伊拉克共和国和IKK),最终导致促炎细胞因子的诱导TNFα,il
- 6,
MCP-1。符合这个模型中,枯氏细胞alcohol-fed老鼠是有限合伙人和展览有限合伙人增加反应敏感,导致更高水平的TNFα(伊2003)和MCP-1
(Mandrekar et al . 2011年)。多种TLRs的增强表达也可促进ros介导的酒精性肝脏库普弗细胞敏化(Gustot et al.
2006)。Hritz及其同事(2008)和Inokuchi及其同事(2011)证实了TLR4在肾上腺脑白质营养不良患者的Kupffer细胞和骨髓来源的免疫细胞上表达的重要性。然而,目前还不清楚肝脏中的kupffer
-cell特异性TLR4是否是唯一导致酒精介导的发病机制的TLR,这个问题需要使用缺乏巨噬细胞特异性TLR4的小鼠进行进一步的研究。然而,到目前为止的研究结果表明,酒精诱导的ROS和kupffer细胞对内毒素的敏感性增加(内毒素可导致促炎反应增强)是ALD中kupffer细胞活化的主要原因。
抑制Kupffer细胞的活化和减少促炎细胞因子——特别是抑制Kupffer细胞产生促炎细胞因子——已经成为缓解ALD的一个重点。例如,可以通过使用脂联素(一种抗炎的脂肪因子)处理酒精暴露的kupffer细胞原代培养物来逆转kupffer细胞敏化(Thakur
et al. 2006)。治疗脂联素球状防止LPS-stimulated TNFα表达通过激活枯氏细胞il - 10 / STAT3 /
hemoxygenase-1通路和诱导M2巨噬细胞(2011年Mandal et al .
2010年)。反过来,M2巨噬细胞似乎与减少或有限的肝损伤相关,因为在目前轻度肝损伤和脂肪变性的饮酒者中,M2巨噬细胞占主导地位,而严重肝损伤的患者则表现为M1巨噬细胞(Wan
et al.
2014)。另一种可能的ALD治疗方法是通过增加IL-10水平来降低酒精暴露的Kupffer细胞的敏感性。酒精诱导的IL-10减少已被证明有助于巨噬细胞的敏化,IL-10缺陷小鼠的研究发现酒精介导的促炎性细胞因子的产生增加(Hill等,2002年)。最近的研究也表明,il
-10通过激活酒精性肝脏中的TLR3起到保护作用(Byun et al.
2013)。选择性地靶向Kupffer细胞中的TLR信号通路可能会对肾上腺脑白质营养不良患者促炎细胞因子的产生平衡的贡献提供更好的见解。
3 .除了TLR3和TLR4外,免疫组化还在酒精性肝炎患者肝脏活检中发现TLR2和TLR8表达增加(Lee et al. 2014)。
ALD中肝浸润巨噬细胞
组织驻留的巨噬细胞,如肝脏中的库普弗细胞,不仅能抵御病原体,还能帮助滋养和维持细胞(如肝细胞)。确保组织内平衡。然而,在没有感染的情况下,由感染或炎症引起的应激条件下(即另外,单核细胞浸润受损组织,分化为巨噬细胞,帮助清除病原体,清除坏死细胞和细胞碎片,恢复组织内环境稳定。事实上,在许多疾病模型中(如腹膜炎症),已被描述的组织巨噬细胞实际上来源于这种浸润的单核细胞(Ghosn
et al. 2010)。
急性和慢性肝损伤的研究也证实了单核细胞的肝内聚集。例如,用四氯化碳(CCl4)对小鼠进行急性处理会导致肝脏损伤,导致巨噬细胞的大量涌入,使肝脏巨噬细胞总数增加10倍(Karlmark等,2009年)。最近一项对慢性ccl4诱导的肝纤维化小鼠的研究表明,巨噬细胞的浸润在纤维化的进展和消退中发挥了重要作用(Ramachandran
et al. 2012)。同样,在对乙酰氨基酚诱导的肝损伤小鼠模型中,恢复期招募的巨噬细胞浸润对组织修复有重要作用(Holt et al. 2008)。
慢性酒精性肝病也可能是通过免疫细胞浸润介导和传播的,因为慢性酒精给药可导致小鼠肝脏中浸润性巨噬细胞的积累(Wang et al.
2014)。浸润的巨噬细胞包括两个亚群- ly -
6chi和Ly-6Clow细胞,具有明显的遗传特征。Ly-6Clow细胞表现出抗炎和组织保护表型,表达低水平的促炎细胞因子和高水平的可能参与组织修复的抗炎分子(Arnold
et al.
2007;Nahrendorf等,2007)。相反,Ly-6Chi细胞表现为促炎组织损伤表型;然而,在吞噬凋亡的肝细胞后,它们似乎转变为Ly-6Clow表型(Wang
et al.
2014)。这两个亚群的浸润巨噬细胞共存,并在许多炎症组织损伤模型中表现出明显的、有时相反的功能。在肾脏损伤模型中,骨髓Ly-6Chi单核细胞被招募到损伤的肾脏,并在那里分化为功能明显的Ly-6Clow细胞(Lin
et al.
2009)。在ccl4诱导的肝纤维化动物肝脏中,来自于Ly-6Chi细胞的Ly-6Clow浸润巨噬细胞对解决炎症和纤维化、恢复组织稳态具有重要作用(Ramachandran
et al.
2012)。对心肌梗死中浸润-巨噬细胞亚群的作用的研究也表明,Ly-6Chi和Ly-6Clow细胞依次招募入组织。促炎细胞Ly-6Chi在损伤早期浸润组织,具有蛋白水解和吞噬功能。在心肌梗死的后期,募集的Ly-6Clow细胞具有减弱的炎症特性,并通过促进血管形成参与组织修复。和心肌细胞的激活(即血管生成)。(Nahrendorf等,2007)。
在人类中,数量的增加(即非经典CD14+CD16+单核细胞与Ly-6Clow浸润巨噬细胞相对应,在多种炎症性疾病中发生,包括类风湿关节炎、动脉粥样硬化、哮喘、特应性湿疹、胰腺炎和肺泡蛋白沉积症。非经典的CD14+CD16+单核细胞也在慢性肝病患者的循环和肝脏中扩张,提示它们参与了肝脏炎症和纤维化的进展(Ziegler-Heitbrock
2007)。
ALD中的巨噬细胞介质
肝脏中存在的非均质和浸润性巨噬细胞具有多种与ALD相关的功能(见图2):
它们可以作为抗原呈递细胞,在表面显示外来分子,从而触发适应性免疫反应。
它们可能表现出被丙二醛-乙醛修饰过的肝蛋白的存在。,丙二醛-乙醛加合物)(Willis等,2002)。这种修饰会改变或损害蛋白质的功能。在ALD患者中,这些加合物也可能与自身抗体的存在有关。
它们通常产生抗菌肽和介质,并具有微生物杀灭活性;然而,这些功能可能在肾上腺脑白质营养不良期间受到损害。
通过激活tlr介导的信号,它们可能导致T细胞上的免疫抑制受体PD-1和TIM-3的表达增加,从而削弱酒精性肝炎患者的抗菌活性(Markwick et al.
2015)。
某些亚群(如Ly6Chi浸润巨噬细胞)产生多种促炎介质,包括活性氧、活性氮、促炎细胞因子和趋化因子,从而导致组织损伤。
ALD中的巨噬细胞介质
肝脏中存在的非均质和浸润性巨噬细胞具有多种与ALD相关的功能(见图2):
它们可以作为抗原呈递细胞,在表面显示外来分子,从而触发适应性免疫反应。
它们可能表现出被丙二醛-乙醛修饰过的肝蛋白的存在。,丙二醛-乙醛加合物)(Willis等,2002)。这种修饰会改变或损害蛋白质的功能。在ALD患者中,这些加合物也可能与自身抗体的存在有关。
它们通常产生抗菌肽和介质,并具有微生物杀灭活性;然而,这些功能可能在肾上腺脑白质营养不良期间受到损害。
通过激活tlr介导的信号,它们可能导致T细胞上的免疫抑制受体PD-1和TIM-3的表达增加,从而削弱酒精性肝炎患者的抗菌活性(Markwick et al.
2015)。
某些亚群(如Ly6Chi浸润巨噬细胞)产生多种促炎介质,包括活性氧、活性氮、促炎细胞因子和趋化因子,从而导致组织损伤。
除了细胞因子和趋化因子外,巨噬细胞的其他介质还包括补体系统和脂联素和瘦素等脂因子。补体C3和C5系统在小鼠ALD的早期被巨噬细胞激活,并促进疾病的发生和发展(Roychowdhury
et al.
2009)。相反,脂肪因子似乎对小鼠肾上腺脑白质营养不良的巨噬细胞功能有负调控作用。因此,有必要寻找新的巨噬细胞介质来调节肾上腺脑白质营养不良的极化,从而影响其发展。
随着肝脏损伤的进展,巨噬细胞也需要通过吞噬作用清除坏死细胞或细胞碎片,这是成功解决炎症和促进组织修复的关键步骤。巨噬细胞的吞噬作用,开始产生抗炎细胞因子,如il
-
10和TGF-β(亨森和布拉顿2013;Korns等人2011年;以及具有促炎作用的生长因子和组织重塑介质。因此,免疫组织化学最近的一项研究观察了强劲TGF-β表达式的巨噬细胞酒精性肝炎患者的肝脏样本(Lee
et al .
2014年)。然而,当肝损伤持续存在时,慢性炎症和组织修复过程可导致组织纤维化。组织供氧量不足(即可能是这一过程中的一个因素,因为在慢性乙醇喂养后观察到肝脏组织缺氧(Arteel等,1996年)。缺氧导致蛋白质的稳定和激活,这些蛋白质被称为缺氧诱导因子(HIFs),它调节多种途径来控制细胞存活、增殖和代谢。巨噬细胞大量聚集在缺氧的损伤组织内(Murdoch
et al. 2005)。小鼠模型的肝损伤、慢性肝损伤诱导的巨噬细胞表达HIF1α,促进纤维化通过调节生产pro-fibrogenic介质(坩埚et al .
2012;Mehal 2012)。
氧化应激介导的巨噬细胞活化以及随后产生的影响巨噬细胞极化的细胞因子是ALD炎症的主要诱因。
ALD的治疗——巨噬细胞是一个可能的目标吗?
不论疾病发展到什么阶段,戒酒一直是肾上腺脑白质退化症最有效的治疗方法。然而,患者往往缺乏动力和依从性,导致复发。另一种方法包括使用锌(Kang和Zhou
2005)、维生素和s
-腺苷蛋氨酸来恢复酒精性肝硬化患者的营养状态,尽管其有益结果有限。水飞蓟素和甜菜碱的替代疗法也被建议用于ALD的未来临床试验(Frazier等,2011年)。抗炎治疗靶向巨噬细胞功能,如用糖皮质激素治疗,pentoxyfylline,或anti-TNFα抗体,也评估了ALD患者30多年。然而,迄今为止,成功是有限的。在急性酒精性肝炎患者中使用糖皮质激素的临床试验显示效果不明显,但最终因为败血症和消化道出血风险增加而终止(Maddrey
et al.
1978)。后来的研究评估治疗的效果与特定anti-TNFα抗体,再次与有限的成功。因此,为酒精性肝炎和肝硬化患者制定有效策略的需求仍然没有得到满足。
为了满足这一需求,研究人员也在评估各种针对巨噬细胞的策略。这些策略通常使用细胞因子抑制剂或细胞内介质来调节细胞因子的产生,有一些有希望的结果:
方法针对饮酒导致IL-1β信号在巨噬细胞使用il - 1受体拮抗剂(如anakinra)取得了减少饮酒导致的小鼠肝脏的炎症反应(Petrasek et al .
2012年)。
利用球状脂联素通过血红素氧合酶-1诱导Kupffer细胞产生IL-10的研究减轻了小鼠ALD (Mandal et al.
2010)。通过调节肝脏中一氧化碳的可利用性来诱导肝巨噬细胞中的这种酶在ALD小鼠模型中也有有益的作用(Bakhautdin et al. 2014)。
围绕Kupffer细胞和小鼠酒精性肝脏中浸润巨噬细胞产生的MCP-1和MIF的研究发现这些趋化因子是有效的靶标(Barnes et al.
2013;Mandrekar等人,2011)。
针对应激诱导的热休克蛋白90的特定抑制剂的策略——目前在癌症临床试验中评估的一种方法——通过抑制小鼠肝脏巨噬细胞炎症反应来帮助改善ALD (Ambade et
al. 2014)。
这些研究共同支持了巨噬细胞靶向治疗在酒精性肝炎患者中的临床评价。针对巨噬细胞功能和表型的生物制剂、小分子药物和抗氧化治疗相结合的临床研究可能为酒精性肝炎和肝硬化的治疗提供持久的疗效。
结论和观点
与许多慢性炎性疾病一样,巨噬细胞已成为ALD的关键参与者,并可能成为治疗目标。然而,由于这些细胞的异质性和表型多样性,耗尽所有的肝巨噬细胞并不是一个有效的方法;最大限度受益的特定人群仍有待确定。
关于肝巨噬细胞在ALD发展中的作用,仍有许多问题需要解决。例如,ALD时肝内浸润的单核细胞如何分化?是什么组织环境信号和分子信号通路驱动了酒精性肝中巨噬细胞的再编程?另一个重要的问题是,在组织内环境恢复稳定后,如何控制浸润巨噬细胞的数量。过多的细胞会凋亡还是会迁移?此外,深入了解控制和调节肝巨噬细胞表型和功能的分子和途径对制定治疗ALD的策略至关重要。例如,在ALD早期,Ly-6Clow浸润巨噬细胞在组织修复和伤口愈合中的功能可以用来预防慢性肝脏炎症。炎症组织损伤的Ly-6Chi浸润巨噬细胞向抗炎组织修复的Ly-6Clow细胞的转化可以作为治疗晚期ALD的靶点,如酒精性脂肪性肝炎,并已在人类和小鼠研究中提出(Singal
et al.
2013)。抑制巨噬细胞介导的炎症反应已经被用作其他条件下的治疗选择;例如,他汀类药物、噻唑烷二酮类药物和n-3脂肪酸等可以预防巨噬细胞介导的炎症,是治疗糖尿病的首选策略(Ji
et al. 2009;Methe et al. 2005;Ramirez等,2008;Yeop Han et al.
2010)。这些治疗方法在减轻酒精性脂肪性肝炎肝损伤和炎症方面的效果也值得评价。
Phenotypic and Functional Heterogeneity of Monocytes and Macrophages
Macrophages, which play an important role in the initial innate immune response
to infection with pathogens or other insults fall into two main
categories—infiltrating macrophages and tissue-resident macrophages.
Infiltrating macrophages are derived from precursor cells called monocytes that
circulate throughout the body and are recruited into the tissues when an
inflammatory reaction occurs. Tissue-resident macrophages, in contrast, always
remain localized within one tissue, serving as sentries and first line of
defense against any infection or injury in that tissue.
Alcohol Research: Current Reviews | Macrophages and Alcohol-Related Liver
Inflammation
https://www.arcr.niaaa.nih.gov/arcr372/article09.htm
巨噬细胞介导炎症在正常和糖尿病创面愈合中的作用
.jpg)
图1所示。
MΦ反应在皮肤伤口。trMΦs来自两个来源:卵黄囊在胚胎和胎儿肝脏。造血作用发生在这些位置,祖细胞,种子组织F4/80hi
MΦs。这两个被招募的单核细胞群来自于骨髓,然后被释放到血液中。组织损伤后,这两个单核细胞的数量是招募网站内的损伤周围组织和分化成MoMΦs。Ly6Chi
(M1) MoMΦs释放促炎介质,而Ly6Clo (M2) MoMΦs分泌抗炎介质。GMP, granulocyte-MΦ祖;造血干细胞;MDP,
MΦ-dendritic细胞祖。
图2。
Stage-dependent MΦs在伤口愈合的功能。ROS,活性氧。

图3。
伤口愈合的表观遗传变化。组蛋白修饰(乙酰化和甲基化)、DNA甲基化和RNA干扰是常见的表观遗传学改变,它们与影响伤口愈合期间炎症的基因表达变化相关。
Macrophage-Mediated Inflammation in Normal and Diabetic Wound Healing | The
Journal of Immunology
https://www.jimmunol.org/content/199/1/17/tab-figures-data
Anti-oxidant inhibition of hyaluronan fragment-induced inflammatory gene expression.
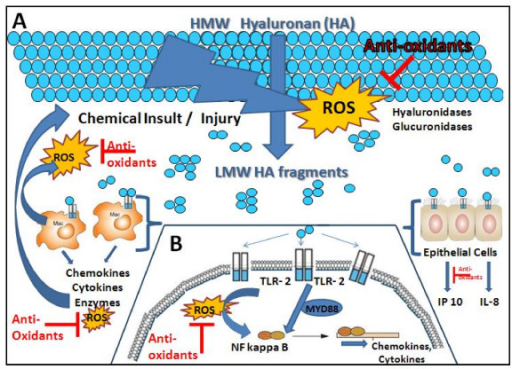
F6: ROS在病理生理“恶性循环”中的中心作用:a)组织损伤产生ROS,介导细胞外基质HA的破碎。B)分散HA和ROS加强通过TLR-2激活先天免疫系统,其次是ROS的产生,进一步激活NF-κB和炎性细胞因子和趋化因子的表达,进一步促进炎症。这个循环使细胞外基质HA的持续碎片化和ROS的生成,从而导致进一步的损伤、炎症和最终的纤维化。抗氧化剂有可能改善这种恶性循环。
The central role of ROS in a pathophysiologic "vic | Open-i
https://openi.nlm.nih.gov/detailedresult?img=PMC2627834_1476-9255-5-20-6&req=4
活性氧在炎症和组织损伤中的作用
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3929010
·活性氧(ROS)的产生是许多炎症疾病进展的关键。ROS由参与宿主防御反应的细胞产生,如多形核中性粒细胞(PMNs),并通过关键的细胞信号蛋白(如酪氨酸磷酸酶)的氧化促进内皮功能障碍。
Reactive Oxygen Species in Inflammation and Tissue Injury
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3929010
Mar 01, 2014 · Production of reactive oxygen species (ROS) is central to the
progression of many inflammatory diseases. The ROS are produced by cells that
are involved in the host-defense response, such as polymorphonuclear neutrophils
(PMNs) and promote endothelial dysfunction by oxidation of crucial cellular
signaling proteins such as tyrosine phosphatases.
活性氧在炎症和组织损伤中的作用
活性氧(ROS)是在炎症性疾病进展中起重要作用的关键信号分子。炎症部位的多形核中性粒细胞(PMNs)增强ROS生成,导致内皮功能障碍和组织损伤。
活性氧在炎症和组织损伤中的作用
www.ncbi.nlm.nih.gov pmc /文章/ PMC3929010 /
Reactive oxygen species (ROS) are key signaling molecules that play an
important role in the progression of inflammatory disorders. An enhanced ROS
generation by polymorphonuclear neutrophils (PMNs) at the site of inflammation
causes endothelial dysfunction and tissue injury.
Reactive Oxygen Species in Inflammation and Tissue Injury
www.ncbi.nlm.nih.gov/pmc/articles/PMC3929010/
谷胱甘肽和硫氧还蛋白抗氧化剂…——cell.com
https://www.cell.com/cancer cell/fulltext/s1535 - 6108 (14) 00470 - x
值得注意的是,联合抑制谷胱甘肽和硫氧还蛋白的抗氧化途径可导致体内外癌细胞的协同死亡,这表明了这两种抗氧化剂对肿瘤进展的重要性,并可作为治疗干预的潜在靶点。
Glutathione and Thioredoxin Antioxidant ... - cell.com
https://www.cell.com/cancer-cell/fulltext/S1535-6108(14)00470-X
Remarkably, combined inhibition of GSH and thioredoxin antioxidant pathways
leads to a synergistic cancer cell death in vitro and in vivo, demonstrating the
importance of these two antioxidants to tumor progression and as potential
targets for therapeutic intervention.
硫氧还蛋白在正常和…反应中的作用
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC543461
·HDACi抑制正常细胞和转化细胞的生长,诱导转化细胞而非正常细胞的凋亡。我们首先测定了SAHA对正常人肺成纤维细胞WI-38及其sv40转化衍生物VA13的影响。萨哈(≥2.5μM)抑制细胞生长的WI38
VA13细胞(图1 A和C)。
Role of thioredoxin in the response of normal and ...
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC543461
Jan 18, 2005 · HDACi Arrests Cell Growth of Normal and Transformed Cells and
Induces Apoptosis of Transformed but Not Normal Cells. We first determined the
effect of SAHA on normal human lung fibroblasts, WI-38 cells, and its
SV40-transformed derivative, VA13. SAHA (≥ 2.5 μM) inhibited cell growth of WI38
and VA13 cells (Fig. 1 A and C).
活性氧的来源
细胞内ROS的一个主要来源是NADPH氧化酶。NADPH氧化酶催化O2和NADPH生成超氧化物。这些酶最初是在吞噬细胞中被发现的,在吞噬细胞中,它们通过在局部产生高水平的氧化应激[9]来杀死被吞噬的病原体。自这一发现以来,已经观察到NADPH氧化酶家族成员存在于机体的许多组织中,这些组织对非免疫功能也很重要[10,11]。专门产生活性氧的酶的存在证实了活性氧在细胞中起控制作用的模型,而不是简单地充当有毒的副产品。此外,致癌基因可以刺激NADPH氧化酶依赖的ROS产生,这已被证明是细胞增殖[12]所必需的。NADPH氧化酶在细胞内定位于许多细胞器,包括质膜、细胞核、线粒体和内质网。有趣的是,内质网最近也被证明有NADPH氧化酶独立产生ROS和[13]。虽然NADPH氧化酶是细胞内ROS的良好来源,但如果可能,这篇综述将着重于线粒体来源的ROS的机制和后果。
细胞ROS的最大贡献者是线粒体。据估计,线粒体总耗氧量的1%用于产生超氧化物[14,15]。线粒体有八个已知的能够产生超氧化物的位点[16,17]。这些位点对细胞总ROS的相对贡献尚不清楚,然而,来自复合物I、II和III的ROS都被证明对细胞信号转导[16]有影响。有趣的是,复合物I和复合物II在线粒体基质中释放ROS,复合物III则有能力在线粒体内膜[18]两侧释放ROS。从理论上讲,将活性氧释放到内膜空间将更容易接近胞质靶。与这一假设相一致的是,复杂iii衍生的ROS已被明确证明在许多生物学过程中需要,包括氧感应、细胞分化和适应性免疫[19]。mROS的其他来源是否对整个mROS信号转导起单独或共同作用尚不清楚。Mitochondrial
reactive oxygen species and cancer | Cancer & Metabolism | Full Text
https://cancerandmetabolism.biomedcentral.com/articles/10.1186/2049-3002-2-17
Cited by: 6
Publish Year: 2013
Author: Federico S. Rodríguez, Katterine A. Salazar, Nery A. Jara, María A
García-Robles, Fernando Pérez, Lu...
Vitamin C in Stem Cell Reprogramming and Cancer
https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(18)30064-3
Sep 01, 2018 · However, elevated basal levels of ROS, deficiency in catalase
activity or increased uptake of vitamin C by tumor cells could render them
selectively vulnerable to the pro-oxidant effect of high-dose vitamin C, and is
an ongoing area of research.
Cited by: 17
Publish Year: 2018
Author: Luisa Cimmino, Benjamin G. Neel, Iannis Aifant
维生素C在干细胞重编程和癌症中的作用
维生素C对人体至关重要,钠依赖的维生素C转运体严格控制血浆水平,而维生素C转运体负责饮食吸收和全身吸收。
维生素C是一种抗氧化剂和铁2 + /α-KGDDs代数余子式。
维生素C通过调节JmjC域含组蛋白去甲基化酶和粉防己碱羟化酶的活性,增强成纤维细胞向iPSCs的表观重编程,并维持ESC的多能性。
维生素C缺乏可通过降低TET羟化酶活性,促进造血干细胞异常自我更新,加速白血病进展。
药理剂量的维生素C可恢复肝星状细胞的粉防己碱功能,对白血病和其他癌症的标准治疗有较好的辅助作用。
维生素C是人类的基本饮食需求。除了作为一种抗氧化剂,维生素C是一个代数余子式铁2 +,α-ketoglutarate-dependent加双氧酶(Fe 2 +
/α-KGDDs)包含大量不同的酶,包括胶原prolyl羟化酶和表观遗传的监管机构的组蛋白和DNA甲基化。维生素C可以调节胚胎干细胞(ESC)功能,提高重组成纤维细胞的诱导多能干细胞(万能),并阻碍的异常自我造血干细胞(hsc)通过其能力提高的活动要么Jumonji
C (JmjC)
domain-containing组蛋白demethylases或一千零一十一易位(春节)DNA羟化酶。鉴于表观遗传失调是已知的恶性肿瘤的驱动因素,维生素C可能作为表观遗传抗癌剂发挥新的作用。
关键字
维生素C
表观遗传学
干细胞
春节的蛋白质
甲基化
癌性维生素C对人体至关重要,而血浆水平受钠依赖性维生素C转运蛋白的严格控制,这些转运蛋白负责饮食吸收和全身吸收。
维生素C是一种抗氧化剂和铁2 + /α-KGDDs代数余子式。
维生素C通过调节JmjC域含组蛋白去甲基化酶和粉防己碱羟化酶的活性,增强成纤维细胞向iPSCs的表观重编程,并维持ESC的多能性。
维生素C缺乏可通过降低TET羟化酶活性,促进造血干细胞异常自我更新,加速白血病进展。
药理剂量的维生素C可恢复肝星状细胞的粉防己碱功能,对白血病和其他癌症的标准治疗有较好的辅助作用。
维生素C是人类的基本饮食需求。除了作为一种抗氧化剂,维生素C是一个代数余子式铁2 +,α-ketoglutarate-dependent加双氧酶(Fe 2 +
/α-KGDDs)包含大量不同的酶,包括胶原prolyl羟化酶和表观遗传的监管机构的组蛋白和DNA甲基化。维生素C可以调节胚胎干细胞(ESC)功能,提高重组成纤维细胞的诱导多能干细胞(万能),并阻碍的异常自我造血干细胞(hsc)通过其能力提高的活动要么Jumonji
C (JmjC)
domain-containing组蛋白demethylases或一千零一十一易位(春节)DNA羟化酶。鉴于表观遗传失调是已知的恶性肿瘤的驱动因素,维生素C可能作为表观遗传抗癌剂发挥新的作用。
关键字
维生素C
表观遗传学
干细胞
春节的蛋白质
甲基化
癌症
Vitamin C in Stem Cell Reprogramming and Cancer: Trends in Cell Biology
https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(18)30064-3
2-DeoxyGlucose (2-DG) - Blog: Cancer Treatments - from ...
https://www.cancertreatmentsresearch.com/2-deoxyglucose-2-dg
Oct 24, 2015 · Summary: This is a glucose analog that is avidly taken up by
cancer cells. DeoxyGlucose (2DG) differs from normal glucose only by removal of
an oxygen atom from the hydroxyl group at the 2 position. 2DG is one of the most
relevant glycolysis inhibitor. Since it is a glycolysis inhibitor, it is
relevant to all cancers visible on PETContinue reading 2-DeoxyGlucose (2-DG)
2-脱氧葡萄糖(2-DG) -网志:癌症治疗-来自…
https://www.cancertreatmentsresearch.com/2-deoxyglucose-2-dg
·总结:这是一种被癌细胞贪婪吸收的葡萄糖模拟物。脱氧葡萄糖(2DG)与正常葡萄糖的区别仅在于2位羟基上的氧原子被去除。2DG是最相关的糖酵解抑制剂之一。由于它是一种糖酵解抑制剂,它与所有在PETContinue上可见的癌症相关,即2-脱氧葡萄糖(2-DG)
Biology of glucose metabolization in cancer cells ...
https://www.sciencedirect.com/science/article/pii/S2452336417300420
After the discovery of based on the altered cancer cell metabolism in 1930,
loads of studies have shed light on several aspects of cancer metabolism with a
common goal to find new ways for effectively eliminating tumor cells by
targeting their energy metabolism.
肿瘤细胞葡萄糖代谢生物学…
https://www.sciencedirect.com/science/article/pii/S2452336417300420
1930年,基于改变的癌细胞代谢的发现,大量的研究揭示了癌症代谢的几个方面,共同的目标是找到新的方法,通过靶向肿瘤细胞的能量代谢来有效地消灭肿瘤细胞。
引用:13
出版年:2017
作者:Adewale Fadaka, Basiru Ajiboye, Oluwafemi Ojo, Olusola Adewale, Israel
Olayide, Rosemary Emuowhocher…
Cited by: 13
Publish Year: 2017
Author: Adewale Fadaka, Basiru Ajiboye, Oluwafemi Ojo, Olusola Adewale, Israel
Olayide, Rosemary Emuowhocher...
TargetingTumor MetabolismWith 2-Deoxyglucose in Patients ...
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4142700
Sep 15, 2010 · DISCUSSION. This is the first study to define the recommended
phase II dose, pharmacokinetics, and molecular marker data for 2DG, a
prototypical inhibitor of glycolysis, as a single agent. The ability to use 2DG
in the clinic lays an important foundation in the effort to target metabolism in
cancer.
2-脱氧葡萄糖靶向肿瘤代谢
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4142700
2010年9月15日这是首次将糖酵解的典型抑制剂2DG作为单一药剂,确定推荐的II期剂量、药代动力学和分子标记数据的研究。将2DG用于临床为肿瘤的靶向代谢研究奠定了重要的基础。
引用:151
出版年:2010
作者:Mark Stein, linhongxia, Chandrika Jeyamohan, Dmitri Dvorzhinski, Murugesan
Gounder, Kevin Bray, Kev…
Cited by: 151
Publish Year: 2010
Author: Mark Stein, Hongxia Lin, Chandrika Jeyamohan, Dmitri Dvorzhinski,
Murugesan Gounder, Kevin Bray, Kev...
A Phase I/II Trial of 2-Deoxyglucose (2DG) for the ...
https://clinicaltrials.gov/ct2/show/NCT00633087
Mar 11, 2008 · A Phase I/II Trial of 2-Deoxyglucose (2DG) for the Treatment of
Advanced Cancer and Hormone Refractory Prostate Cancer (2-Deoxyglucose) Fasting
blood glucose < institutional ULN. In the Phase I portion of this study patients
may have had prior chemotherapy. In the Phase II portion of this study patients
may not have had prior chemotherapy. Women of childbearing potential must have a
…
2-脱氧葡萄糖(2DG)的I/II期试验。
https://clinicaltrials.gov/ct2/show/NCT00633087
·2-脱氧葡萄糖(2DG)治疗晚期癌症和激素难治性前列腺癌(2-脱氧葡萄糖)的I/II期试验在本研究的第一阶段,患者可能已经有过化疗史。在本研究的第二阶段,患者可能之前没有接受过化疗。有生育潜力的妇女必须有……